
【题目】下表是甲、乙、丙、丁四种有机物的有关信息:
甲 | ①能使溴的四氯化碳溶液褪色; ②能与水在一定条件下反应生成丙; ③比例模型为 |
乙 | ①由C、H两种元素组成; ②比例模型为 |
丙 | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与丁反应生成相对分子质量为100的酯 |
丁 | ①由C、H、O三种元素组成; ②球棍模型为 |
回答下列问题:
(1)甲与溴的四氯化碳溶液反应的生成物的结构简式是__。
(2)乙具有的性质是__(填序号)。
A.无色无味液体,有毒
B.不溶于水,密度比水的大
C.不能使酸性KMnO4溶液褪色
D.任何条件下不与氢气反应
(3)丙的官能团的名称:__;写出丙与Na反应的化学方程式:__。
(4)甲与氢气发生加成反应后生成物质戊,与戊在结构上相似的有机物有一大类(即“同系物”),它们均符合通式CnH2n+2。当n≥__时,这类有机物出现同分异构现象。
(5)丙与丁反应能生成相对分子质量为100的酯,该反应的反应类型为__;其化学方程式为___。
【答案】CH2BrCH2Br C 羟基 2C2H5OH+2Na→2C2H5ONa+H2↑ 4 酯化反应/取代反应 CH2=CH-COOH+C2H5OH![]() CH2=CH-COOC2H5+H2O
CH2=CH-COOC2H5+H2O
【解析】
比例模型为 能使溴的四氯化碳溶液褪色,则甲是乙烯CH2=CH2;甲能与水在一定条件下反应生成丙,则丙为CH3CH2OH;乙由C、H两种元素组成;比例模型为
能使溴的四氯化碳溶液褪色,则甲是乙烯CH2=CH2;甲能与水在一定条件下反应生成丙,则丙为CH3CH2OH;乙由C、H两种元素组成;比例模型为 ,则乙是C6H6;丁由C、H、O三种元素组成;球棍模型为
,则乙是C6H6;丁由C、H、O三种元素组成;球棍模型为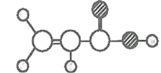 ,则丁是CH2=CH-COOH。
,则丁是CH2=CH-COOH。
(1)甲是乙烯,与溴的四氯化碳溶液反应的生成物的结构简式是:CH2BrCH2Br,故答案为:CH2BrCH2Br;
(2)乙是苯,苯为无色带有特殊气味的液体,有毒,故A错误;不溶于水,密度小于水,故B错误;和酸性高锰酸钾不反应,故C正确;在Ni的催化剂作用下可与H2发生加成反应,故D错误;故答案为:C;
(3)丙的CH3CH2OH,官能团的名称:羟基,乙醇与Na反应的化学方程式:2C2H5OH+2Na→2C2H5ONa+H2↑,故答案为:羟基;2C2H5OH+2Na→2C2H5ONa+H2↑;
(4)甲与氢气发生加成反应后生成物质戊,则戊为CH3CH3,戊的同系物中,当n≥4时,这类有机物出现同分异构现象,故答案为:4;
(5)丙是CH3CH2OH,丁是CH2=CH-COOH,两者反应能生成酯,该反应的反应类型为酯化反应或取代反应,化学方程式为:CH2=CH-COOH+C2H5OH![]() CH2=CH-COOC2H5+H2O,故答案为:酯化反应/取代反应;CH2=CH-COOH+C2H5OH
CH2=CH-COOC2H5+H2O,故答案为:酯化反应/取代反应;CH2=CH-COOH+C2H5OH![]() CH2=CH-COOC2H5+H2O。
CH2=CH-COOC2H5+H2O。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A.金属钠晶体中,Na的原子半径为acm,则其晶体密度为![]()
B.常温下醋酸铵溶液的pH=7,则0.1mol·L-1该溶液中c(CH3COO-)=c(NH![]() )=0.1mol·L-1
)=0.1mol·L-1
C.标准状况下,11.2L HF分子中F原子数为0.5NA
D.5.6g铁粉与稀硝酸反应,转移的电子数一定为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.反应![]() 在室温下可自发进行,则该反应的
在室温下可自发进行,则该反应的![]()
B.![]() 溶液加水稀释后,溶液中
溶液加水稀释后,溶液中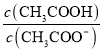 的值减小
的值减小
C.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀
D.![]() 溶液中加入少量
溶液中加入少量![]() 固体,
固体,![]() 的水解程度减小,溶液的
的水解程度减小,溶液的![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁分别为A、B、C、D四种短周期元素的最高价氧化物对应的水化物,已知0.1mol·L-1甲、丙、丁溶液的pH与A、C、D的原子序数关系如图所示(lg2=0.3),且常温下甲、丙、丁均可与乙反应。下列说法正确的是( )
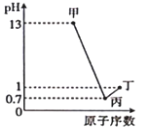
A.简单离子半径: D>C>B>A
B.A、C形成的化合物水溶液呈碱性
C.C、D形成的氢化物稳定性:C>D
D.A、B分别与D形成的化合物均为离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含乳酸(HA表示乳酸分子,A-表示乳酸根离子)废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,下列说法正确的是( )
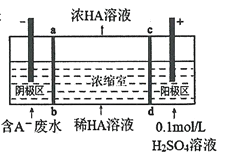
A.阴极区电极反应式为4OH--4e-=2H2O+O2↑
B.交换膜cd为阳离子交换膜,H+从阳极区通过阳离子交换膜进入浓缩室
C.通电一段时间后浓缩室水的量减少,导致乳酸溶液增大
D.当电路中通过1mol电子的电量时,两极一定共产生11.2L(标准状况下)气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素N、S、![]() 可形成多种物质,在工业生产上有着广泛的应用。请回答下列问题:
可形成多种物质,在工业生产上有着广泛的应用。请回答下列问题:
(1)Se与S是同族元素,请写出基态Se原子的电子排布式:__。N与S是不同族元素,请解释NH3在水中的溶解度比H2S大的原因:__。
(2)有一种由1~9号元素中的部分元素组成,且与SCl2互为等电子体的共价化合物,它的分子式为__。借助等电子体原理可以分析出SCN-中σ键和π键的个数比为__。
(3)已知![]() 的结构为
的结构为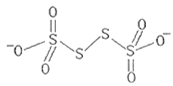 其中S原子的杂化方式是__。
其中S原子的杂化方式是__。
(4)N、P可分别形成多种三角锥形分子,已知NH3的键角大于PH3,原因是__。
(5)离子晶体中阳离子和阴离子的半径比不同可形成不同的晶胞结构,见下表:
半径比 | 0.225~0.414 | 0.414~0.732 | 0.732~1 |
典型化学式 | 立方ZnS | NaCl | CsCl |
晶胞 |
|
|
|
已知某离子晶体RA,其阴阳离子半径分别为184pm和74pm,摩尔质量为Mg/mol,则阳离子配位数为__,晶体的密度为__g/cm3(列出计算式,无需化简,设NA为阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发的对二甲苯合成流程如图所示。下列说法正确的是( )
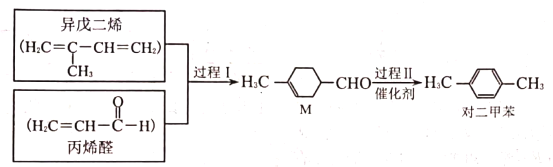
A.过程Ⅰ发生的是取代反应
B.可用溴水鉴别![]() 和对二甲苯
和对二甲苯
C.对二甲苯的密度比水大
D.![]() 的某种同分异构体含有苯环且能与钠反应放出氢气
的某种同分异构体含有苯环且能与钠反应放出氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸是生活中常见的有机物之一,不仅是食醋的主要成分,在工业上也可用于制氢,已知如下反应:
热裂解反应:![]()
![]()
脱羧基反应:![]()
![]()
合成乙酸反应:![]()
![]()
(1)请写出![]() 与
与![]() 甲醇化的热化学方程式________。
甲醇化的热化学方程式________。
(2)在密闭容器中,利用乙酸制甲烷,若要使甲烷的产率较高,制备时选择的适宜条件为________。
a.较低温度 b.较大压强 c.高温 d.低压
(3)向一恒容密闭容器充入一定量的乙酸气体发生反应,相同时间后,测得温度与气体产率的关系如图:
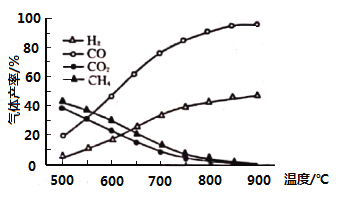
①约![]() 之前氢气产率低于甲烷的可能原因是________。而
之前氢气产率低于甲烷的可能原因是________。而![]() 之后氢气产率高于甲烷的理由是________。
之后氢气产率高于甲烷的理由是________。
②一定温度下,若在充入容器的乙酸气体中掺杂一定量水蒸气,氢气产率显著提高而![]() 产率下降,原因是________(用化学方程式表示)。
产率下降,原因是________(用化学方程式表示)。
(4)温度为![]() 时,在密闭容器中充入一定量乙酸气体,若利用合适的催化剂控制不发生其他的副反应,达到平衡时总压强为
时,在密闭容器中充入一定量乙酸气体,若利用合适的催化剂控制不发生其他的副反应,达到平衡时总压强为![]() ,热裂解反应消耗乙酸
,热裂解反应消耗乙酸![]() ,脱羧基反应消耗乙酸
,脱羧基反应消耗乙酸![]() ,乙酸的体积分数为________;脱羧基反应的平衡常数
,乙酸的体积分数为________;脱羧基反应的平衡常数![]() =________
=________![]() (
(![]() 为以分压表示的平衡常数)。
为以分压表示的平衡常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语书写正确的是( )
A.金属发生电化学腐蚀的正极反应式:M-ne-=Mn+
B.家用小苏打溶于水后的电离:NaHCO3=Na++H++CO![]()
C.氯化铁溶液制备氢氧化铁胶体:Fe3++3H2O=Fe(OH)3↓+H+
D.用碳酸钠溶液处理锅炉水垢中的硫酸钙:CaSO4(s)+CO![]() (aq)CaCO3(s)+SO
(aq)CaCO3(s)+SO![]() (aq)
(aq)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com