
【题目】我国学者最近研发一种新型铝—石墨烯电池,其负极是金属铝,正极是石墨烯(Cn)薄膜,电解质为阳离子(EMI+)与阴离子(![]() )组成的离子液体,该电池的工作原理如图。已知能量密度是指一定质量物质中储存能量的大小。下列说法错误的是
)组成的离子液体,该电池的工作原理如图。已知能量密度是指一定质量物质中储存能量的大小。下列说法错误的是
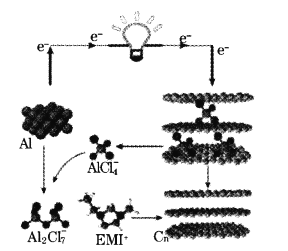
A.该铝电极电池比锂电极电池的能量密度低
B.石墨烯电极的比表面积大,充放电性能优于石墨电极
C.充电时,有机阳离子(EMI+)向铝电极移动
D.放电时,负极的电极反应式为2Al+7Clˉ-6eˉ=Al2Cl![]()
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.反应![]() 在室温下可自发进行,则该反应的
在室温下可自发进行,则该反应的![]()
B.![]() 溶液加水稀释后,溶液中
溶液加水稀释后,溶液中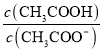 的值减小
的值减小
C.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀
D.![]() 溶液中加入少量
溶液中加入少量![]() 固体,
固体,![]() 的水解程度减小,溶液的
的水解程度减小,溶液的![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发的对二甲苯合成流程如图所示。下列说法正确的是( )
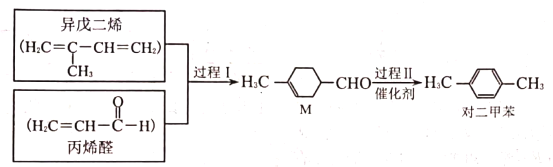
A.过程Ⅰ发生的是取代反应
B.可用溴水鉴别![]() 和对二甲苯
和对二甲苯
C.对二甲苯的密度比水大
D.![]() 的某种同分异构体含有苯环且能与钠反应放出氢气
的某种同分异构体含有苯环且能与钠反应放出氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸是生活中常见的有机物之一,不仅是食醋的主要成分,在工业上也可用于制氢,已知如下反应:
热裂解反应:![]()
![]()
脱羧基反应:![]()
![]()
合成乙酸反应:![]()
![]()
(1)请写出![]() 与
与![]() 甲醇化的热化学方程式________。
甲醇化的热化学方程式________。
(2)在密闭容器中,利用乙酸制甲烷,若要使甲烷的产率较高,制备时选择的适宜条件为________。
a.较低温度 b.较大压强 c.高温 d.低压
(3)向一恒容密闭容器充入一定量的乙酸气体发生反应,相同时间后,测得温度与气体产率的关系如图:
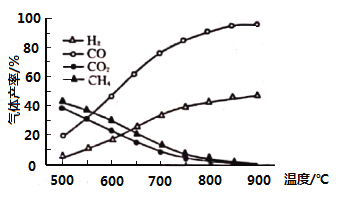
①约![]() 之前氢气产率低于甲烷的可能原因是________。而
之前氢气产率低于甲烷的可能原因是________。而![]() 之后氢气产率高于甲烷的理由是________。
之后氢气产率高于甲烷的理由是________。
②一定温度下,若在充入容器的乙酸气体中掺杂一定量水蒸气,氢气产率显著提高而![]() 产率下降,原因是________(用化学方程式表示)。
产率下降,原因是________(用化学方程式表示)。
(4)温度为![]() 时,在密闭容器中充入一定量乙酸气体,若利用合适的催化剂控制不发生其他的副反应,达到平衡时总压强为
时,在密闭容器中充入一定量乙酸气体,若利用合适的催化剂控制不发生其他的副反应,达到平衡时总压强为![]() ,热裂解反应消耗乙酸
,热裂解反应消耗乙酸![]() ,脱羧基反应消耗乙酸
,脱羧基反应消耗乙酸![]() ,乙酸的体积分数为________;脱羧基反应的平衡常数
,乙酸的体积分数为________;脱羧基反应的平衡常数![]() =________
=________![]() (
(![]() 为以分压表示的平衡常数)。
为以分压表示的平衡常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林(Aspirin,乙酰水杨酸)具有解热止痛,抑制血小板凝聚,防止血栓形成的功效,是家庭中常备药品。水杨酸与乙酸酐反应制取阿司匹林的原理如图:
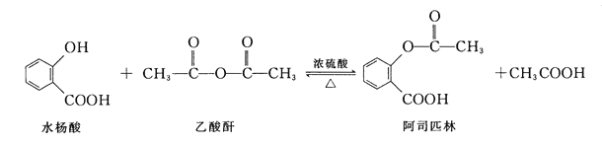
下列有关说法错误的是
A.水杨酸分子中所有原子可能共面
B.水杨酸的同分异构体中,属于苯环上二元取代物的还有5种(不考虑过氧键)
C.乙酰水杨酸在一定条件下能发生加成、水解、酯化等反应
D.分离乙酰水杨酸和乙酸可以加入饱和Na2CO3溶液后分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 Kx[Cu(C2O4)y]·zH2O (水合草酸铜(Ⅱ)酸钾)是一种化工原料,实验室制备少量水合草酸铜酸钾并测定样品的组成,实验步骤如下:
I制备CuO
用图1所示装置将溶液混合后,小火加热至蓝色沉淀变黑色生成CuO,煮沸5~10分钟。稍冷却后全部转移至图2装置过滤,并用蒸馏水洗涤沉淀2~3次。
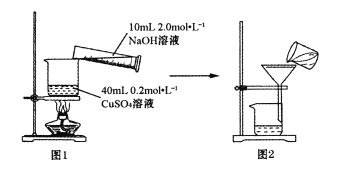
(1)①指出图2装置中操作中的错误___________,图2操作需用蒸馏水洗涤沉淀2~3次,其目为___________。
②检验沉淀洗涤干净的方法为___________。
Ⅱ制备KHC2O4和K2C2O4混合溶液
称取3.0g H2C2O4·2H2O放入250mL烧杯中,加入40mL蒸馏水,微热(温度低于80℃)溶解。稍冷后分数次加入2.2g无水K2CO3,充分反应后生成含KHC2O4和K2C2O4的混合物。
(2)该步骤中所得混合物中n(KHC2O4):n(K2C2O4)=____________。(取整数)
Ⅲ制备水合草酸铜酸钾晶体
将KHC2O4和K2C2O4混合溶液水浴微热,再将CuO连同滤纸一起加入到该溶液中,充分反应至CuO沉淀全部溶解,取出滤纸后,加热浓缩、冷却结晶、过滤,用乙醇淋洗,自然晾干,称量得到样品2.9760g(电子天平称量)。
(3)①步骤Ⅲ中KHC2O4的作用是__________。
②用乙醇淋洗而不用水的优点是__________。
③溶解CuO沉淀时,连同滤纸一起加人到溶液中的目的是__________。
Ⅳ测定水合草酸铜酸钾晶体的成分
取少量制得的样品配成溶液。用标准酸性髙锰酸钾溶液滴定![]() 、用标准EDTA溶液(PAR为指示剂)滴定Cu2+,经计算样品中n(Cu):n(
、用标准EDTA溶液(PAR为指示剂)滴定Cu2+,经计算样品中n(Cu):n(![]() )=1:2,假设制备样品的过程中Cu2+无损耗。
)=1:2,假设制备样品的过程中Cu2+无损耗。
(4)水合草酸铜(Ⅱ)酸钾晶体的化学式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)为原料制备铁黄(FeOOH)的一种工艺流程如下:
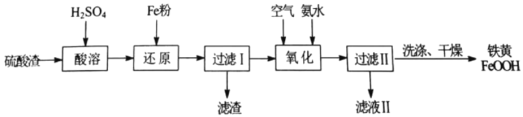
(1)“酸溶”时加快溶解的方法可以是________。(写出一种)
(2)“还原”过程中主要反应的离子方程式为________。
(3)“氧化”过程中,生成FeOOH的离子方程式为________。
(4)“过滤Ⅱ”所得铁黄在洗涤过程中,检验铁黄表面已洗涤干净的操作是________。
(5)实验测得反应溶液的![]() 、温度对铁黄产率的影响如图1、图2所示。
、温度对铁黄产率的影响如图1、图2所示。
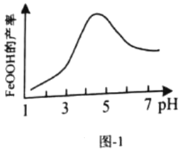
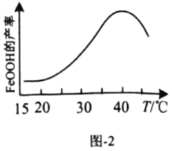
①反应温度宜选择________;
②氧化时应控制pH的合理范围是4.5左右,pH过小或过大均会导致铁黄产率较低,其可能原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语书写正确的是( )
A.金属发生电化学腐蚀的正极反应式:M-ne-=Mn+
B.家用小苏打溶于水后的电离:NaHCO3=Na++H++CO![]()
C.氯化铁溶液制备氢氧化铁胶体:Fe3++3H2O=Fe(OH)3↓+H+
D.用碳酸钠溶液处理锅炉水垢中的硫酸钙:CaSO4(s)+CO![]() (aq)CaCO3(s)+SO
(aq)CaCO3(s)+SO![]() (aq)
(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能被视为最具发展潜力的清洁能源,开发新型储氢材料是氢能利用的重要研究方向。请回答下列问题:
Ⅰ.化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB=NH)3通过如下反应制得:3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3。
(1)基态B原子的价电子排布式为_____,B、C、N、O第一电离能由大到小的顺序为_____,CH4、NH3、CO2的键角按照由大到小的顺序排列为_____。
Ⅱ.氢气的安全贮存和运输是氢能应用的关键。
(1)印度尼赫鲁先进科学研究中心的Datta和Pati等人借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种材料的分子呈平面结构(如图),每个杂环平面上下两侧最多可吸附10个H2分子。
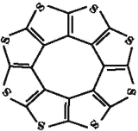
①S的基态原子中能量最高的电子,其原子轨道呈_____形。
②C16S8与H2微粒间的作用力是_____。
③C16S8分子中C原子和S原子的杂化轨道类型分别为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com