
【题目】以硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)为原料制备铁黄(FeOOH)的一种工艺流程如下:
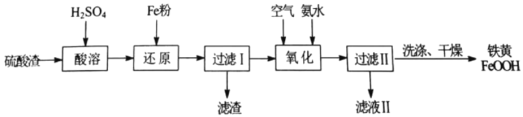
(1)“酸溶”时加快溶解的方法可以是________。(写出一种)
(2)“还原”过程中主要反应的离子方程式为________。
(3)“氧化”过程中,生成FeOOH的离子方程式为________。
(4)“过滤Ⅱ”所得铁黄在洗涤过程中,检验铁黄表面已洗涤干净的操作是________。
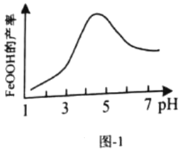
(5)实验测得反应溶液的![]() 、温度对铁黄产率的影响如图1、图2所示。
、温度对铁黄产率的影响如图1、图2所示。
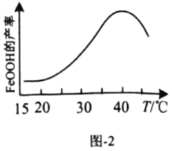
①反应温度宜选择________;
②氧化时应控制pH的合理范围是4.5左右,pH过小或过大均会导致铁黄产率较低,其可能原因是________。
【答案】快速搅拌或适当提高酸溶时温度 Fe+2Fe3+=3Fe2+ ![]() 取最后一次洗涤滤液,滴加盐酸酸化的BaCl2溶液,若无白色沉淀,说明已洗涤干净 40℃ pH过低导致Fe3+不可能完全转为铁黄,pH过大导致部分Fe3+会转化为Fe(OH)3
取最后一次洗涤滤液,滴加盐酸酸化的BaCl2溶液,若无白色沉淀,说明已洗涤干净 40℃ pH过低导致Fe3+不可能完全转为铁黄,pH过大导致部分Fe3+会转化为Fe(OH)3
【解析】
硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)加硫酸溶解,金属氧化物转化为金属阳离子,二氧化硅不溶,再加铁粉把铁离子还原为Fe2+,之后进行过滤,滤渣主要为不溶于稀硫酸的二氧化硅,滤液中含有Fe2+和Al3+,滤液中通入空气氧化,同时加入氨水调节pH生成FeOOH沉淀,过滤、洗涤、烘干,得到纯净的FeOOH;
(1)快速搅拌、适当提高酸溶时温度均可以加快溶解的速率;
(2)还原过程主要为铁粉和铁离子的反应,离子方程式为Fe+2Fe3+=3Fe2+;
(3)根据流程可知氧化过程中氧化剂为O2,Fe2+在碱性环境中被氧化成FeOOH,铁元素化合价升高1价,所以反应中Fe2+和O2的系数比为4:1,再结合元素守恒可得离子方程式为![]() ;
;
(4)根据整个流程可知生成的铁黄表面可能附着硫酸铵,所以需要检验铁黄表面是否存在硫酸根来验证铁黄是否洗涤干净,具体操作为:取最后一次洗涤滤液,滴加盐酸酸化的BaCl2溶液,若无白色沉淀,说明已洗涤干净;
(5)①据图可知温度为40℃时铁黄的产率最高,所以温度选40℃;
②pH过低导致Fe3+不可能完全转为铁黄,pH过大导致部分Fe3+会转化为Fe(OH)3,所以pH过小或过大均会导致铁黄产率较低。


科目:高中化学 来源: 题型:
【题目】用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示(电极材料为石墨)。下列有关叙述不正确的是( )
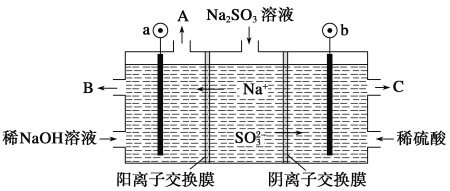
A.图中a极连接电源的负极
B.A口放出的物质是氢气,C口放出的物质是氧气
C.b极电极反应式为:SO32--2e-+H2O===SO42-+2H+
D.电解过程中阴极区碱性明显增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨是重要的战略物资,2016年我国江西省发现超大型钨矿,再次刷新钨矿储量的世界纪录。由钨铁矿(主要成分是![]() ,还含有少量
,还含有少量![]() )制取钨的工业流程如下(已知:常温下,钨酸难溶于水)。
)制取钨的工业流程如下(已知:常温下,钨酸难溶于水)。
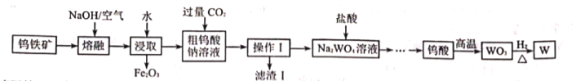
请回答下列有关问题:
(1)浸取后进行的分离操作的名称是________。
(2)滤渣![]() 的主要成分是________(填化学式),写出生成该物质的离子方程式________。
的主要成分是________(填化学式),写出生成该物质的离子方程式________。
(3)已知![]() 中铁元素的化合价为+2价,
中铁元素的化合价为+2价,![]() 在熔融过程中发生反应的化学方程式为________。
在熔融过程中发生反应的化学方程式为________。
(4)在![]() 溶液中加入盐酸时,为了防止局部酸度过大,应采取的措施是________。
溶液中加入盐酸时,为了防止局部酸度过大,应采取的措施是________。
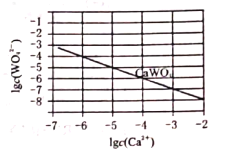
(5)如图为![]() 在常温下的沉淀溶解平衡曲线,若将
在常温下的沉淀溶解平衡曲线,若将![]() 的
的![]() 溶液与
溶液与![]() 的
的![]() 溶液按体积比2:1混合,要产生
溶液按体积比2:1混合,要产生![]() 沉淀,则
沉淀,则![]() ________。(忽略溶液体积变化)
________。(忽略溶液体积变化)
(6)用碳化钨![]() 作阳极,不锈钢作阴极,
作阳极,不锈钢作阴极,![]() 溶液作电解液,通过电解可以回收钨,电解后阳极上析出钨酸并放出
溶液作电解液,通过电解可以回收钨,电解后阳极上析出钨酸并放出![]() ,则阳极反应式为________;若在标准状况下放出
,则阳极反应式为________;若在标准状况下放出![]() ,则阳极增重的质量为________
,则阳极增重的质量为________![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国学者最近研发一种新型铝—石墨烯电池,其负极是金属铝,正极是石墨烯(Cn)薄膜,电解质为阳离子(EMI+)与阴离子(![]() )组成的离子液体,该电池的工作原理如图。已知能量密度是指一定质量物质中储存能量的大小。下列说法错误的是
)组成的离子液体,该电池的工作原理如图。已知能量密度是指一定质量物质中储存能量的大小。下列说法错误的是
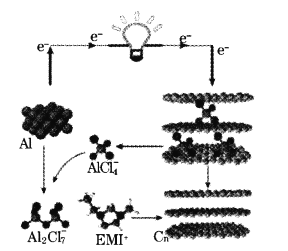
A.该铝电极电池比锂电极电池的能量密度低
B.石墨烯电极的比表面积大,充放电性能优于石墨电极
C.充电时,有机阳离子(EMI+)向铝电极移动
D.放电时,负极的电极反应式为2Al+7Clˉ-6eˉ=Al2Cl![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A为合成某种抗支气管哮喘药物的中间体,A的结构如下图所示,下列说法正确的是( )
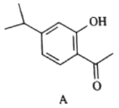
A.每个A分子中含有一个手性碳原子
B.A中所有碳原子可处于同一平面
C.A不能发生氧化反应
D.1molA最多可与4molH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10 mL 0.2 mol/L的KIO3溶液中逐渐加入NaHSO3粉末,生成的I2的物质的量随所加NaHSO3的物质的量变化如图所示,下列说法不正确的是( )

A.A点对应的I2的物质的量为1.0×10-3 mol
B.oa : ab = 4 : 1
C.当溶液中的n(I2) = 5×10-4 mol时,加入NaHSO3的物质的量可能为2.5×10-3 mol或5.5×10-3 mol
D.由ab段反应可知,氧化性I2 >![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】六氟磷酸钠(NaPF6)极易溶于水,可溶于乙醇、丙酮等有机溶剂,可作高能钠电池的电解质。工业上以氟磷灰石[Ca5(PO4)3F]、NaCl为主要原料,制备六氟磷酸钠的工艺流程如下:
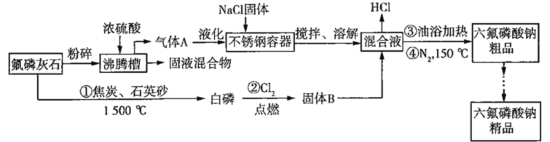
已知:HF的熔点为-83 ℃,沸点为19.5 ℃。回答下列问题:
(1)氟磷灰石粉碎的目的是_______________。
(2)HF液化时产生的二聚物(HF)2能发生微弱的电离,与NaCl反应生成NaHF2,请写出该二聚物的电离方程式:________。
(3)为避免废水NaH2PO4的污染,常在其中加入石灰,将磷元素全部转化成磷酸钙,进行回收利用。已知常温下Ksp[Ca3(PO4)2]=1.96×10-29,当处理后的废水c(Ca2+)=1.0×10-5 mol/L时,则溶液中c(![]() )=___________mol/L。
)=___________mol/L。
(4)操作③油浴加热目的是________。
(5)反应①中除生成白磷(P4)外,还产生SiF4和一种还原性气体,写出该反应的化学方程式:______。
(6)六氟磷酸钠粗品的提纯:将六氟磷酸钠粗品(杂质主要是微量铁盐)溶于一定量乙醇中,加入适量5%的NaOH甲醇溶液,使溶液保持碱性,离心将不溶杂质除去。通过______(填操作方法)将溶剂回收,减压条件下结晶,得到NaPF6·H2O,干燥得到无水盐。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢(H2S)是一种无色具有臭鸡蛋气味、能溶于水的高毒性的化合物,其广泛存在化石燃料加工的尾气中。为避免污染环境,可用活性炭材料进行脱硫,脱硫的方法有物理吸附法、化学吸附法和氧化法。
(1)物理吸附法:
物理吸附法是先将尾气缓缓通过活性炭,将H2S从尾气中转移到活性炭的微孔或表面,这是利用活性炭的___性。
(2)氧化法:
利用吸附在活性炭表面上的活性氧(O),将H2S氧化成S而除去,该反应的化学方程式是___。
(3)化学吸附法:
①利用H2S能溶于水,形成硫化氢溶液,更易被活性炭吸附。若0.1molL-1H2S的pH约为4,则H2S在水溶液中的电离方程式是___,被吸附的离子主要有___。
②工业生产中用CuCl2溶液处理活性炭的工艺称为活性炭的改性,改性后的活性炭能提高化学吸附法中H2S的吸收量。
i.用不同浓度的CuCl2溶液改性后的活性炭对H2S吸附量的影响如图所示。随着CuCl2溶液浓度的升高,活性炭对硫化氢吸附量不再增加,原因是过多金属离子阻塞活性炭内部的微孔结构,导致活性炭的吸附能力下降。改性后的活性炭,能提高H2S吸附量的原因是___(用离子方程式表示)。
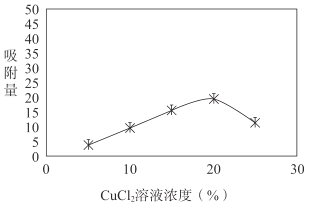
ii.水膜处理对活性炭吸附H2S量也有影响。测定含水量不同时,活性炭对硫化氢吸附量的影响,实验结果如下表。
载水率(%) | 0 | 5.32 | 10.23 | 15.33 | 20.19 |
吸附量(mg/g—活性炭) | 19.62 | 21.52 | 32.42 | 31.28 | 30.78 |
注:载水率即单位质量的活性炭吸附水的质量。
活性炭载水率为10%以上时,吸附量降低,其可能的原因是___。
(4)下列关于活性炭处理H2S尾气的说法正确的是___(选填字母序号)。
a.化学吸附过程中存在着电离平衡的移动
b.活性炭改性时,CuCl2溶液的浓度越大,H2S的吸附量越大
c.其他条件相同时,低温、缓慢通入尾气更有利于H2S的物理吸附
d.适当提高活性炭的载水率,可提高H2S吸附量的原因是活性炭吸附离子比吸附分子能力更强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.饱和Na2CO3溶液与CaSO4固体反应:CO![]() +CaSO4=CaCO3+SO
+CaSO4=CaCO3+SO![]()
B.酸化NaIO3和NaI的溶液混合:I-+IO![]() +6H+=I2+3H2O
+6H+=I2+3H2O
C.KClO碱性溶液与Fe(OH)3反应:3ClO-+2Fe(OH)3=2FeO![]() +3Cl-+4H++H2O
+3Cl-+4H++H2O
D.电解饱和食盐水:2Cl-+2H+![]() Cl2↑+H2↑
Cl2↑+H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com