
【题目】有机物A为合成某种抗支气管哮喘药物的中间体,A的结构如下图所示,下列说法正确的是( )
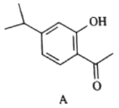
A.每个A分子中含有一个手性碳原子
B.A中所有碳原子可处于同一平面
C.A不能发生氧化反应
D.1molA最多可与4molH2发生加成反应
科目:高中化学 来源: 题型:
【题目】高铁酸钾(![]() )是复合型的水处理剂,以废铁屑(含有
)是复合型的水处理剂,以废铁屑(含有![]() 、
、![]() 、油污等杂质)为原料制备的流程如下:
、油污等杂质)为原料制备的流程如下:
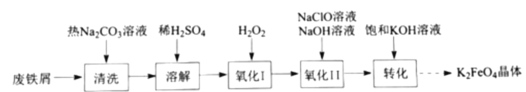
(1)热的![]() 溶液清洗废铁屑的目的是_________。
溶液清洗废铁屑的目的是_________。
(2)氧化Ⅰ中![]() 被氧化成
被氧化成![]() 的离子方程式为________。
的离子方程式为________。
(3)![]() 溶液在不同
溶液在不同![]() 下,
下,![]() 的浓度随时间的变化如图所示。氧化Ⅱ制备
的浓度随时间的变化如图所示。氧化Ⅱ制备![]() 时,选用的加料方式是_________(填字母),原因是________。
时,选用的加料方式是_________(填字母),原因是________。

A. 将![]() 、
、![]() 混合液与氧化Ⅰ所得溶液同时加入到反应容器中
混合液与氧化Ⅰ所得溶液同时加入到反应容器中
B. 将![]() 、
、![]() 混合液缓慢加入到盛有氧化Ⅰ所得溶液的反应容器中
混合液缓慢加入到盛有氧化Ⅰ所得溶液的反应容器中
C. 将氧化Ⅰ所得溶液缓慢加入到盛有![]() 、
、![]() 混合液的反应容器中
混合液的反应容器中
(4)转化步骤中加入饱和![]() 溶液,析出
溶液,析出![]() 晶体的原因是________。
晶体的原因是________。
(5)高铁酸钾是高效复合型的水处理剂的原因:①高铁酸钾有强氧化性,可以用于杀菌消毒;②________。
(6)高铁酸钾可用于高铁电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为![]() ,放电时正极的电极反应式为________。
,放电时正极的电极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】拉曼光谱证实,![]() 在水中转化为[Al(OH)4]-。将一定量的Na2CO3、NaAlO2固体混合物溶于适量水中,再逐滴加入1mol/L盐酸,测得溶液中
在水中转化为[Al(OH)4]-。将一定量的Na2CO3、NaAlO2固体混合物溶于适量水中,再逐滴加入1mol/L盐酸,测得溶液中![]() 、
、![]() 、[Al(OH)4]-、Al3+的物质的量与加入盐酸的体积变化关系如图所示,则下列说法正确的是
、[Al(OH)4]-、Al3+的物质的量与加入盐酸的体积变化关系如图所示,则下列说法正确的是
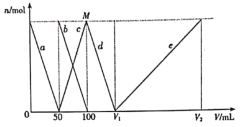
A.![]() 、
、![]() 和[Al(OH)4]-在水溶液中可大量共存
和[Al(OH)4]-在水溶液中可大量共存
B.d线表示的反应为:[Al(OH)4]-+H+=Al(OH)3↓+H2O
C.原固体混合物中![]() 与
与![]() 的物质的量之比为1:1
的物质的量之比为1:1
D.V1=150mL,V2=300mL;M点生成的CO2为0.05mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林(Aspirin,乙酰水杨酸)具有解热止痛,抑制血小板凝聚,防止血栓形成的功效,是家庭中常备药品。水杨酸与乙酸酐反应制取阿司匹林的原理如图:
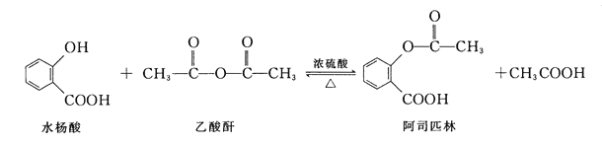
下列有关说法错误的是
A.水杨酸分子中所有原子可能共面
B.水杨酸的同分异构体中,属于苯环上二元取代物的还有5种(不考虑过氧键)
C.乙酰水杨酸在一定条件下能发生加成、水解、酯化等反应
D.分离乙酰水杨酸和乙酸可以加入饱和Na2CO3溶液后分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产生活及科学研究方面应用非常广泛。
(1)基态Fe原子的价层电子的电子排布图为_________________,其最外层电子的电子云形状为___________。
(2)(NH4)2Fe(SO4)26H2O俗称摩尔盐。
①O、S两元素的电负性由大到小的顺序为_____________(用元素符号表示)。
②N、O两元素的的第一电离能由大到小的顺序为___________(用元素符号表示)。
③SO42-中S原子的杂化方式为___________,VSEPR模型名称为___________________。
(3)Fe3+可与某阴离子发生特征的显色反应,用于鉴定Fe3+。该阴离子的电子式为_____,σ键和π键的数目之比为______________。其空间构型为__________。
(4)K3[Fe(CN)6]晶体中配离子的配位体为_____(用化学符号表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)为原料制备铁黄(FeOOH)的一种工艺流程如下:
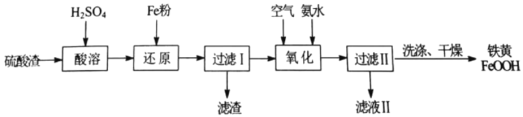
(1)“酸溶”时加快溶解的方法可以是________。(写出一种)
(2)“还原”过程中主要反应的离子方程式为________。
(3)“氧化”过程中,生成FeOOH的离子方程式为________。
(4)“过滤Ⅱ”所得铁黄在洗涤过程中,检验铁黄表面已洗涤干净的操作是________。
(5)实验测得反应溶液的![]() 、温度对铁黄产率的影响如图1、图2所示。
、温度对铁黄产率的影响如图1、图2所示。
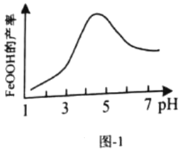
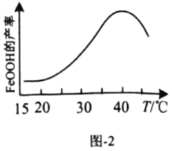
①反应温度宜选择________;
②氧化时应控制pH的合理范围是4.5左右,pH过小或过大均会导致铁黄产率较低,其可能原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是( )
A.BrCH2CHBrCH2Br的名称为三溴丙烷
B.甘氨酸和丙氨酸混合物脱水成肽,最多可生成4种二肽
C.萘环(![]() )上的一个H 原子被—C4H9 取代后的产物共有32种
)上的一个H 原子被—C4H9 取代后的产物共有32种
D.C3H6 和C4H8 不一定是同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家研发了“全氢电池”,其工作原理如图所示。下列说法不正确的是( )

A.吸附层b为电池的正极
B.“全氢电池”的总反应为:H++OH-=H2O
C.NaClO4的作用是传导离子并参与电极反应
D.Na+在装置中从左侧透过阳离子交换膜向右侧移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法正确的是

A. 电池工作时,负极可发生反应:2Li2S6+2Li++2e-=3Li2S4
B. 电池充电时间越长,电池中的Li2S2量越多
C. 电解质中加入硫酸能增强导电性
D. 电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com