
【题目】下列关于有机化合物的说法正确的是( )
A.BrCH2CHBrCH2Br的名称为三溴丙烷
B.甘氨酸和丙氨酸混合物脱水成肽,最多可生成4种二肽
C.萘环(![]() )上的一个H 原子被—C4H9 取代后的产物共有32种
)上的一个H 原子被—C4H9 取代后的产物共有32种
D.C3H6 和C4H8 不一定是同系物
【答案】BD
【解析】
A.BrCH2CHBrCH2Br的名称为1,2,3-三溴丙烷,A说法错误;
B.甘氨酸:NH2-CH2-COOH,丙氨酸:NH2-CH(CH3)-COOH,甘氨酸和丙氨酸混合物脱水成肽,可生成NH2-CH2-CONH-CH2-COOH、NH2-CH2-CONH-CH(CH3)-COOH、NH2-CH(CH3)-CONH-CH2-COOH、NH2-CH(CH3)-CONH-CH(CH3)-COOH,合计4种二肽,B说法正确;
C.萘环(![]() )为对称结构,其上的一个H原子有
)为对称结构,其上的一个H原子有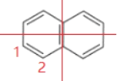 2种位置,-C4H9有4种同分异构体,被-C4H9取代后的产物共有2×4=8种,C说法错误;
2种位置,-C4H9有4种同分异构体,被-C4H9取代后的产物共有2×4=8种,C说法错误;
D.C3H6和C4H8可能是环烷烃,也能为烯烃,不一定是同系物,D说法正确;
答案选BD。


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】药物阿司匹林可由水杨酸制得,它们的结构如图所示有关说法正确的是
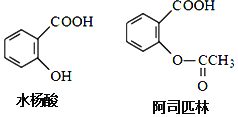
A.服用阿司匹林,身体出现水杨酸不良反应时,可静脉注射NaHCO3溶液
B.阿司匹林的分子式为C9H10O4
C.水杨酸可以发生取代、加成、氧化、加聚反应
D.1mol阿司匹林最多可消耗2molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予约翰·古德伊纳夫、斯坦利·惠廷厄姆和吉野彰三位科学家,以表彰他们在锂电池领域所做出的巨大贡献,![]() 常用作锂离子电池的正极材料。请回答下列问题:
常用作锂离子电池的正极材料。请回答下列问题:
(1)基态钴原子核外占据最高能级的电子云轮廓图为________形。
(2)![]() 中
中![]() 的配位数为4。
的配位数为4。
①配体中![]() 原子的杂化方式为________,该配离子中各元素的第一电离能由小到大的顺序为________(填元素符号)。
原子的杂化方式为________,该配离子中各元素的第一电离能由小到大的顺序为________(填元素符号)。
②![]() 的立体构型是________;与
的立体构型是________;与![]() 互为等电子体的分子和离子为________(各写一种)。
互为等电子体的分子和离子为________(各写一种)。
(3)![]() 是钴的重要化合物。
是钴的重要化合物。![]() 键角小于
键角小于![]() 的键角,原因是________。
的键角,原因是________。
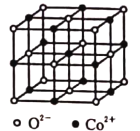
(4)一氧化钴的晶胞如图所示,在每个![]() 的周围与它距离最近的
的周围与它距离最近的![]() 共有________个,若
共有________个,若![]() 晶体的密度为
晶体的密度为![]() ,则晶体中
,则晶体中![]() 与
与![]() 之间的最小距离为________
之间的最小距离为________![]() 。(用含
。(用含![]() 和
和![]() 的代数式表示。
的代数式表示。![]() 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A为合成某种抗支气管哮喘药物的中间体,A的结构如下图所示,下列说法正确的是( )
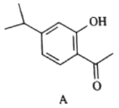
A.每个A分子中含有一个手性碳原子
B.A中所有碳原子可处于同一平面
C.A不能发生氧化反应
D.1molA最多可与4molH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用科学技术减少氮氧化物等物质的排放可促进社会主义生态文明建设。
(1)用CH4催化还原氮氧化物的相关热化学方程式如下:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) △H=-662 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(l) △H=-1248 kJ/mol
反应CH4(g)+2NO2(g)= N2(g) +CO2(g)+2H2O(l) △H=________kJ/mol
(2)氮氧化物可用碱溶液吸收。NO和NO2混合气体按一定比例被NaOH溶液完全吸收生成NaNO2和H2O,写出该反应的化学方程式________;若反应过程中消耗NaOH的物质的量为3 mol,则理论上被吸收的NO和NO2混合气体的总体积在标准状况下为________L。
(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图1所示:
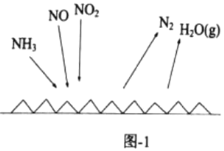
①由图1可知SCR技术中的还原剂为________。
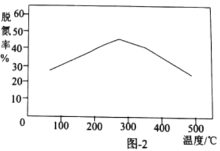
②一定时间内,用Fe作催化剂,氨气按一定的比例催化还原氮氧化物时,不同温度下的脱氮率如图2所示,温度高于300℃时,脱氮率随温度的升高而下降的原因可能是________。
(4)利用反应6NO2+8NH3=7N2+12H2O设计成原电池,既能减轻氮氧化物对环境的污染,又能充分利用化学能,装置如图3所示。
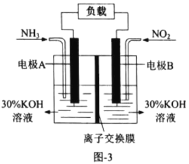
①电极B是________极(填“正”或者“负”)。
②A电极的电极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】六氟磷酸钠(NaPF6)极易溶于水,可溶于乙醇、丙酮等有机溶剂,可作高能钠电池的电解质。工业上以氟磷灰石[Ca5(PO4)3F]、NaCl为主要原料,制备六氟磷酸钠的工艺流程如下:
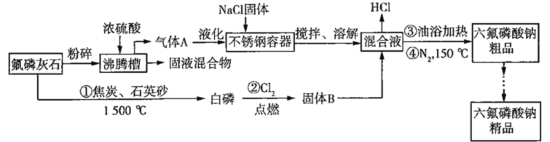
已知:HF的熔点为-83 ℃,沸点为19.5 ℃。回答下列问题:
(1)氟磷灰石粉碎的目的是_______________。
(2)HF液化时产生的二聚物(HF)2能发生微弱的电离,与NaCl反应生成NaHF2,请写出该二聚物的电离方程式:________。
(3)为避免废水NaH2PO4的污染,常在其中加入石灰,将磷元素全部转化成磷酸钙,进行回收利用。已知常温下Ksp[Ca3(PO4)2]=1.96×10-29,当处理后的废水c(Ca2+)=1.0×10-5 mol/L时,则溶液中c(![]() )=___________mol/L。
)=___________mol/L。
(4)操作③油浴加热目的是________。
(5)反应①中除生成白磷(P4)外,还产生SiF4和一种还原性气体,写出该反应的化学方程式:______。
(6)六氟磷酸钠粗品的提纯:将六氟磷酸钠粗品(杂质主要是微量铁盐)溶于一定量乙醇中,加入适量5%的NaOH甲醇溶液,使溶液保持碱性,离心将不溶杂质除去。通过______(填操作方法)将溶剂回收,减压条件下结晶,得到NaPF6·H2O,干燥得到无水盐。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是半导体光电化学电池光解水制氢的反应原理示意图。在光照下,电子由价带跃迁到导带后,然后流向对电极。下列说法不正确的是

A. 对电极的电极反应式为:2H++2e-=H2↑
B. 半导体电极发生还原反应
C. 电解质溶液中阳离子向对电极移动
D. 整个过程中实现了太阳能→电能→化学能的转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】GaAs晶体的熔点很高, 硬度很大, 密度为ρ g·cm-3,Ga 和As 的摩尔质量分别为MGag·mol-1和MAs g·mol-1, 原子半径分别为rGa pm 和rAs pm, 阿伏加德罗常数值为NA, 其晶胞结构如下图所示, 下列说法错误的是
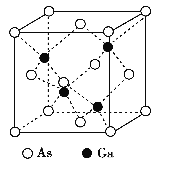
A. 该晶体为原子晶体
B. 在该晶体中,Ga和As均无孤对电子,Ga和As的配位数均为4
C. 原子的体积占晶胞体积的百分率为![]()
D. 所有原子均满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
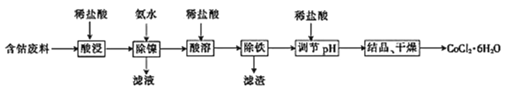
【题目】常温下,用含钴废料(主要成分为CoCO3,还含有少量NiCO3与铁屑)制备CoCl26H2O的工艺流程如图。
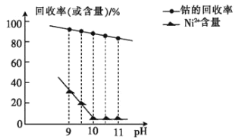
①已知除镍过程中溶液pH对钴的回收率及Ni2+含量的影响如图所示。
②部分金属阳离子在实验条件下开始沉淀和完全沉淀的pH如表所示:
金属阳离子 | 开始沉淀pH | 完全沉淀pH |
Fe3+ | 1.5 | 4.0 |
Fe2+ | 7.5 | 9.7 |
Co2+ | 6.6 | 9.4 |
Ni2+ | 7.7 | 9.5 |
回答下列问题:
(1)酸浸后溶液中的阳离子为:Co2+,Ni2+和__。
(2)除镍时,应调节溶液pH=__,此时Ni2+是否形成Ni(OH)2沉淀?___(是或否)。若pH过小,则产品纯度会___(升高,降低,或不变)。
(3)酸溶时,当调节pH=8时,溶液中n(Fe3+):n(Co2+)=__。
已知Ksp[Co(OH)2]=2.0×10-16,Ksp[Fe(OH)3]=4.0×10-38。
(4)除铁时先向溶液中加入30%的H2O2发生的离子反应方程式是:__。充分反应后再向溶液中加入CoCO3,调节溶液pH范围为__,使Fe3+完全转化为Fe(OH)3沉淀,最后过滤得到CoCl2溶液。
(5)已知Ag++SCN-=AgSCN↓,为测定粗产品中CoCl26H2O的含量,称取11.9g粗产品配成100mL溶液,从中取出25mL先加入含0.03mol的AgNO3,(杂质不与其反应),再用0.5mol/L的KSCN溶液标定过量的AgNO3,该标定操作所用的指示剂为__(填化学式),若消耗20.00mL的KSCN溶液,则该粗产品中CoCl26H2O的质量分数为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com