
【题目】乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4·xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。该组同学的研究课题是:探究测定草酸晶体(H2C2O4·xH2O)中的x值。通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O,学习小组的同学设计了滴定的方法测定x值。
①称取1.260 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4。
③用浓度为0.1000 mol·L-1的酸性KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL。
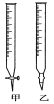
(1)滴定时,将酸性KMnO4标准液装在如图中的________(填“甲”或“乙”)滴定管中。
(2)本实验滴定达到终点的标志是___________________。
(3)通过上述数据,求得x=________。
讨论:①若滴定终点时俯视滴定管刻度,则由此测得的x值会________(填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x值会________。
【答案】甲 当滴入最后一滴KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色,即达滴定终点 2 偏大 偏小
【解析】
(1)因为酸性高锰酸钾溶液具有强氧化性,结合滴定管的适用要求作答;
(2)根据KMnO4溶液自身的颜色作为指示剂判断滴定终点;
(3)由题给化学方程式及数据计算出1.260g纯草酸晶体中含H2C2O4的物质的量,然后求出1.260g纯草酸晶体中含H2O的物质的量,根据H2O的物质的量和纯草酸晶体的物质的量的关系求出x;根据操作不当对标准液消耗的体积变化来判断H2C2O4的物质的量的误差,进而推出纯草酸晶体中含H2O的物质的量误差变化。
(1)酸性高锰酸钾溶液具有强氧化性,腐蚀橡皮管,所以用需用酸式滴定管,甲正确,
故答案为:甲;
(2)当滴入最后一滴KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色,即达滴定终点;
(3)2MnO4+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O
2 5
0.1000mol/L×0.01L 0.0025mol
25.00 mL待测液中含有0.0025 mol H2C2O4,100.00 mL待测液中含有0.01mol H2C2O4,其质量为0.01 mol×90 g/mol=0.9 g,所以1.260 g纯草酸晶体中水的物质的量为1.260 g0.9 g=0.36 g,其物质的量为0.02 mol,则x=2;
①若滴定终点时俯视滴定管读数,则所得消耗酸性KMnO4溶液的体积偏小,由此所得n(H2C2O4)偏小,则n(H2O)偏大,x值偏大;
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则消耗的标准液的体积偏大,最终导致n(H2C2O4)偏大,则n(H2O)偏小,x值偏小;
故答案为:2;偏大;偏小。


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、X均为中学化学常见物质,一定条件下它们有如图所示转化关系(部分产物已略去)。下列说法正确的是( )

A. 若X为KOH溶液,则A可能为Al
B. 若X为Fe,则C可能为Fe(NO3)2溶液
C. 若A、B、C均为焰色反应呈黄色的化合物,则X一定为CO2
D. 若X为O2,则A可为有机物乙醇,也可为非金属单质硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是
2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是

A. ①中溶液橙色加深,③中溶液变黄
B. ②中Cr2O72-被C2H5OH还原
C. 对比②和④可知K2Cr2O7酸性溶液氧化性强
D. 若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无 “0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗
B.用电子天平称量化学药品时,必须先称小烧杯的质量,再称量加入试剂后的总质量,两者之差即为药品的质量
C.金属着火时,可用细沙覆盖灭火;电器设备引起的火灾,不可用泡沫灭火器灭火
D.在4mL0.1mol·L-1的K2Cr2O7溶液中滴加数滴1mol·L-1的NaOH溶液,溶液颜色从橙色变成黄色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作、现象和目的或结论的说法正确的是( )
选项 | 操作 | 目的或结论 |
A | 将Fe(NO3)2晶体溶于稀硫酸后,滴加KSCN溶液,观察溶液是否变化 | 检验Fe(NO3)2样品是否已被氧化而变质 |
B | 海带提碘实验中,为了制取海带灰的浸取液,需要煮沸海带灰和水的混合物1-2min | 主要目的是去除溶液中的氧气,避免氧气氧化碘离子 |
C | 在试管中依次加入2mL浓硫酸、3mL乙醇和2mL乙酸,用酒精灯缓慢加热 | 制备乙酸乙酯 |
D | 向盛有少量Mg(OH)2固体的试管中加入适量NH4Cl浓溶液,充分震荡,白色固体溶解 | NH4+与Mg(OH)2溶解出的OH-结合,导致Mg(OH)2溶解 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
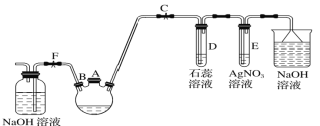
【题目】化学兴趣小组学生用如图所示的装置探究苯和液溴的反应并制备溴苯。
请分析后回答下列问题:
(1)关闭F夹,打开C夹,由A口向装有少量苯的三颈烧瓶中加入少量液溴,再加入少量铁屑,塞住A口,则三颈烧瓶中发生反应的化学方程式:______________。
(2)D试管内出现的现象为________________________________________。
(3)三颈烧瓶右侧导管特别长,除导气外还起的作用是_______________。
(4)在三颈烧瓶中仍有气泡冒出时打开F夹,关闭C夹,可以看到的现象是__________。
(5)反应结束后分离三颈烧瓶中的溴苯的实验方法是__________________。(铁屑已分离)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)在不同条件下分解产物不同,200 ℃时在Cu表面分解的机理如图甲所示。已知200 ℃时:
反应Ⅰ:3N2H4(g)===N2(g)+4NH3(g) ΔH1=-32.9 kJ·mol-1
反应Ⅱ:N2H4(g)+H2(g)===2NH3(g) ΔH2=-41.8 kJ·mol-1
下列说法中不正确的是 ( )
A.图所示过程①、②都是放热反应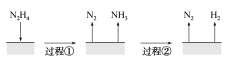
B.反应Ⅱ的能量过程示意图如图所示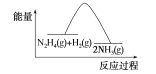
C.断裂3 mol N2H4(g)中的化学键吸收的能量小于形成1 mol N2(g)和4 mol NH3(g)中的化学键释放的能量
D.200 ℃时,肼分解生成氮气和氢气的热化学方程式为N2H4(g)===N2(g)+2H2(g) ΔH=+50.7 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊是中学化学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去)。下列说法不正确的是
( )。
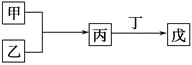
A. 若组成甲、乙的元素位于同一周期,则戊可能是一种弱酸
B. 若组成甲、乙的元素位于同一主族,则戊可能是一种弱酸
C. 若甲为短周期中原子半径最大的主族元素形成的单质,且戊为碱,则丙只能为Na2O2
D. 若丙、丁混合生成白烟,且丙为18电子分子,丁为10电子分子,则乙的水溶液可能具有漂白作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上从电解精炼铜的阳极泥(含金、银、铜、硒等单质)中提取硒的湿法工艺流程如下:
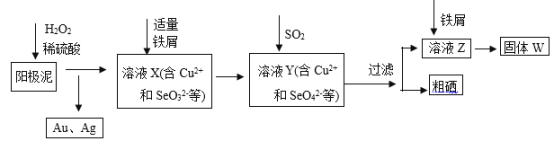
(1)向溶液X中加入铁屑的作用是______ ,此操作中不能加入过量铁粉的原因是______。
(2)检验溶液Z中阴离子的操作方法是______。
(3)过滤操作中要用到玻璃棒,请另举两例用到玻璃棒的实验或操作:______。
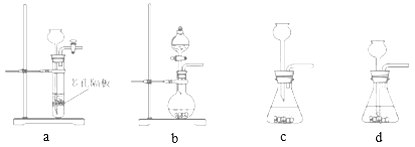
(4)实验室中制取SO2的原理为:Na2SO3+H2SO4=Na2SO4+H2O+SO2↑,此处应使用______(填“较浓的硫酸”或“稀硫酸”),原因是 ______。制取SO2的装置,最好选用下图中的______。
(5)粗硒中硒的含量可用如下方法测定:
①Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O
②SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O
③I2+2Na2S2O3=Na2S4O6+2NaI
通过用Na2S2O3标准溶液(显碱性)滴定反应②中生成的I2来计算硒的含量。滴定操作中用到的玻璃仪器有_______。实验中准确称量0.1200g粗硒样品,滴定中消耗0.2000mol/L的Na2S2O3溶液27.60mL,则粗硒样品中硒的质量分数为_______ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com