
【题目】工业上从电解精炼铜的阳极泥(含金、银、铜、硒等单质)中提取硒的湿法工艺流程如下:
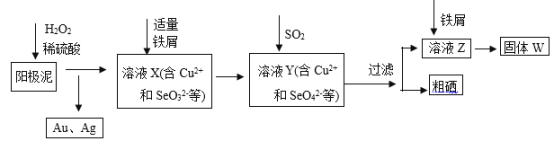
(1)向溶液X中加入铁屑的作用是______ ,此操作中不能加入过量铁粉的原因是______。
(2)检验溶液Z中阴离子的操作方法是______。
(3)过滤操作中要用到玻璃棒,请另举两例用到玻璃棒的实验或操作:______。
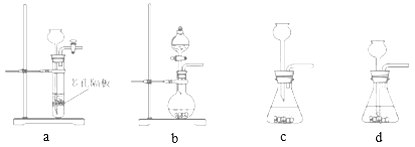
(4)实验室中制取SO2的原理为:Na2SO3+H2SO4=Na2SO4+H2O+SO2↑,此处应使用______(填“较浓的硫酸”或“稀硫酸”),原因是 ______。制取SO2的装置,最好选用下图中的______。
(5)粗硒中硒的含量可用如下方法测定:
①Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O
②SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O
③I2+2Na2S2O3=Na2S4O6+2NaI
通过用Na2S2O3标准溶液(显碱性)滴定反应②中生成的I2来计算硒的含量。滴定操作中用到的玻璃仪器有_______。实验中准确称量0.1200g粗硒样品,滴定中消耗0.2000mol/L的Na2S2O3溶液27.60mL,则粗硒样品中硒的质量分数为_______ 。
【答案】将SeO42-还原为SeO32- 过量铁粉会将Cu2+、SeO32-均还原为单质,不利于硒的分离 取溶液X少许置于试管中,滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明溶液中含有SO42- 粗盐提纯、一定物质的量浓度溶液的配制、物质的溶解、溶液的蒸发、浓硫酸的稀释等 较浓的硫酸 SO2易溶于水,用较浓的硫酸有利于SO2的逸出 b 锥形瓶、碱式滴定管 90.85%
【解析】
(1)根据流程图中加入铁屑前后溶液中的离子种类的变化确定加入铁粉的作用,结合铁粉还原性分析加入量的多少的影响;
(2)根据流程图可知前面加入了SO2,则溶液中含有SO42-,根据检验SO42-的方法分析;
(3)根据玻璃棒在实验中的作用分析;
(4)SO2在水中的溶解度较大,在浓硫酸中溶解度较小;根据反应的特点选择装置;
(5)Na2S2O3标准溶液显碱性应用碱式滴定管盛放,待测溶液用锥形瓶盛放;根据反应的方程式可知,SeO2~2I2~4Na2S2O3,根据n=c·V计算消耗的n(Na2S2O3),根据关系式计算样品中n(SeO2),再根据m=n·M计算Se的质量,进而计算样品中Se的质量分数。
(1)根据流程图可知:加入铁屑后溶液中的SeO42-被还原为SeO32-,所以向溶液X中加入铁屑的作用是:将SeO42-还原为SeO32-;铁粉具有较强的还原性,能还原Cu2+、SeO32-,所以加过量铁粉会将Cu2+、SeO32-均还原为单质,不利于硒的分离;
(2)根据流程图可知前面加入SO2,则溶液中有SO42-,检验SO42-的方法为:取溶液X少许置于试管中,滴加盐酸酸化,然后再加入BaCl2溶液,若有白色沉淀生成,说明溶液中含有SO42-;
(3)实验操作中常常用到玻璃棒,溶解时用玻璃杯搅拌,过滤时用玻璃棒引流,溶液蒸发用玻璃棒搅拌等;
(4)SO2在水中的溶解度较大,在浓硫酸中溶解度较小,用较浓的硫酸有利于SO2的逸出,所以选用较浓的硫酸与亚硫酸钠反应;根据实验室中制取SO2的原理为:Na2SO3+H2SO4=Na2SO4+H2O+SO2↑,可知该反应为固体粉末与液体的反应,反应不需要加热,使用分液漏斗加硫酸容易控制加入硫酸的量,所以最好选用如图2中的b;
(5)Na2S2O3是强碱弱酸盐,在溶液中水解使溶液显碱性,所以Na2S2O3标准溶液应用碱式滴定管盛放,待测溶液用锥形瓶盛放,则滴定操作中用到的玻璃仪器有锥形瓶、碱式滴定管;
根据已知反应的方程式可得关系式:SeO2~2I2~4Na2S2O3,反应消耗Na2S2O3的物质的量n(Na2S2O3)=0.2000mol/L×0.0276L=0.00552mol,则样品中SeO2的物质的量n(SeO2)=![]() ×0.00552mol=0.00138mol,所以Se的质量为0.00138mol×79g/mol=0.10902g,样品中Se的质量分数为
×0.00552mol=0.00138mol,所以Se的质量为0.00138mol×79g/mol=0.10902g,样品中Se的质量分数为![]() ×100%=90.85%。
×100%=90.85%。


科目:高中化学 来源: 题型:
【题目】乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4·xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。该组同学的研究课题是:探究测定草酸晶体(H2C2O4·xH2O)中的x值。通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O,学习小组的同学设计了滴定的方法测定x值。
①称取1.260 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4。
③用浓度为0.1000 mol·L-1的酸性KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL。
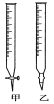
(1)滴定时,将酸性KMnO4标准液装在如图中的________(填“甲”或“乙”)滴定管中。
(2)本实验滴定达到终点的标志是___________________。
(3)通过上述数据,求得x=________。
讨论:①若滴定终点时俯视滴定管刻度,则由此测得的x值会________(填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x值会________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D 均是短周期元素,A 和 B 同周期, B 和 C 同族,A 元素族序数是周期数的三倍,B 原子最外层电子数是内层电子数的二倍,B 与 A 能生成化合物 BA2,C 与 A 生 成化合物 CA2, A 的阴离子与 D 的阳离子电子层结构相同,都与氖原子的电子层结构相同, D 的单质与 A 的单质在不同条件下反应,可生成 D2A 或 D2A2。请回答
(1)写出元素符号 B:_____C:_____
(2)D2A2 的化学式_____.
(3)BA2 的电子式_____,BA2 分子中化学键属于_____键。
(4)C 在元素周期表中的位置是第_____周期_____族,其原子结构示意图为______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷是一种重要的基础化工原料,不仅可制备多种重要有机产品,还可用于环境保护。请回答下列问题:
(1)用甲烷催化还原氮的氧化物可消除氮氧化物的污染。已知:

反应过程(2)是__反应(填“放热”或“吸热”),甲烷还原NO2生成H2O(g)、N2和CO2时的热化学方程式是__。
(2)工厂利用甲烷与氯气的反应原理制取氯甲烷,为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏。化学家研究在催化条件下,通过下列反应:CCl4(g)+H2(g)![]() CHCl3(g)+HCl(g),使CCl4转化为重要的化工原料氯仿(CHCl3)(不考虑副反应)。在固定容积为2L的密闭容器中,该反应达到平衡后,测得如下数据:
CHCl3(g)+HCl(g),使CCl4转化为重要的化工原料氯仿(CHCl3)(不考虑副反应)。在固定容积为2L的密闭容器中,该反应达到平衡后,测得如下数据:
实验 序号 | 温度℃ | 初始n(CCl4)( mol) | 初始n(H2)( mol) | 平衡时n(CHCl3)( mol) |
1 | 110 | 0.8 | 1.2 | |
2 | 110 | 2 | 2 | 1 |
3 | 100 | 1 | 1 | 0.6 |
①此反应在110℃时平衡常数为___。
②实验l中,CCl4的转化率为__。
③判断该反应的正反应是__(填“放热”或“吸热”),理由是__。
④为提高实验3中CCl4的转化率,可采取的措施是__。
a.使用高效催化剂
b.向容器中再投入1molCCl4和1molH2
c.温度升高到200℃
d.向容器中再投入1molHCl
e.向容器中再投入1molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MgCO3和CaCO3的能量关系如图所示(M=Ca、Mg):
M2+(g)+CO32-(g) ![]() M2+(g)+O2(g)+CO2(g)
M2+(g)+O2(g)+CO2(g)
![]()
![]()
![]()
已知:离子电荷相同时,半径越小,离子键越强。下列说法不正确的是
A. ΔH1(MgCO3)>ΔH1(CaCO3)>0
B. ΔH2(MgCO3)=ΔH2(CaCO3)>0
C. ΔH1(CaCO3)-ΔH1(MgCO3)=ΔH3(CaO)-ΔH3(MgO)
D. 对于MgCO3和CaCO3,ΔH1+ΔH2>ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是

A.用图1所示装置除去Cl2中含有的少量HCl
B.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图3所示装置制取少量纯净的CO2气体
D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 电解饱和食盐水可制取烧碱、氯气、氢气
B. 从海水中可提取镁、溴、碘等物质
C. 粗铜(含少量Zn、Fe、Pt等)电解精炼后,溶液中金属阳离子只有Fe2+、Zn2+
D. 在镀件上镀铜,镀件作阴极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化钛(TiO2)广泛应用于各类结构表面涂料、纸张涂层等,二氧化钛还可作为制备乙酸、钛单质的原料。
Ⅰ.二氧化钛可由以下两种方法制备:
方法1:TiCl4水解生成TiO2·xH2O,过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到胶体TiO2,此方法制备得到的是纳米二氧化钛。
(1)① TiCl4水解生成TiO2·x H2O的化学方程式为______;
②检验TiO2·x H2O中Cl-是否被除净的方法是___________
方法2:可用含有Fe2O3的钛铁矿(主要成分为FeTiO3,其中Ti元素化合价为+4价)制取,其主要流程如下:
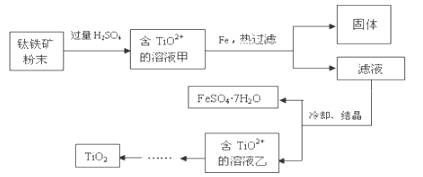
(2)溶液甲中加入Fe的作用是__________
(3)若要加热FeSO4.7H2O晶体得无水硫酸亚铁,除酒精灯、玻璃棒外,还要用到的两种硅酸盐质仪器是__________
Ⅱ.二氧化钛的用途:
(4)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
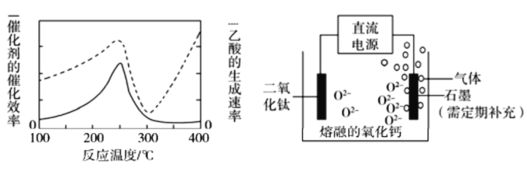
在不同温度下催化剂的催化效率与乙酸的生成速率如图所示(实线表示的是催化剂的催化效率,虚线表示的是乙酸的生成速率),250~300 ℃时,温度升高而乙酸的生成速率降低的原因是______。
(5)TiO2直接电解法生产钛是一种较先进的方法,电解质为熔融的氧化钙,原理如图所示,二氧化钛电极连接电源_____(填“正极”或“负极”),该极电极反应式为__________。石墨极上石墨参与反应产生的气体是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是( )

A. 加热时,①中上部汇集了NH4Cl固体
B. 加热时,②中溶液变红,冷却后又都变为无色
C. 加热时,③中溶液红色褪去,冷却后溶液变红,体现SO2的漂白性
D. 三个“封管实验”中所发生的化学反应都是可逆反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com