
����Ŀ��������һ����Ҫ�Ļ�������ԭ�ϣ��������Ʊ�������Ҫ�л���Ʒ���������ڻ�����������ش��������⣺
��1���ü������ԭ��������������������������Ⱦ����֪��

��Ӧ���̣�2����__��Ӧ�����������������������������黹ԭNO2����H2O(g)��N2��CO2ʱ���Ȼ�ѧ����ʽ��__��
��2���������ü����������ķ�Ӧԭ����ȡ�ȼ��飬Ϊ���ƴ����ȼ���������ҵ�ĸ�����CCl4���Լ�����Գ�������ƻ�����ѧ���о��ڴ������£�ͨ�����з�Ӧ��CCl4(g)+H2(g)![]() CHCl3(g)+HCl(g)��ʹCCl4ת��Ϊ��Ҫ�Ļ���ԭ���ȷ�(CHCl3)�������Ǹ���Ӧ�����ڹ̶��ݻ�Ϊ2L���ܱ������У��÷�Ӧ�ﵽƽ�����������ݣ�
CHCl3(g)+HCl(g)��ʹCCl4ת��Ϊ��Ҫ�Ļ���ԭ���ȷ�(CHCl3)�������Ǹ���Ӧ�����ڹ̶��ݻ�Ϊ2L���ܱ������У��÷�Ӧ�ﵽƽ�����������ݣ�
ʵ�� ��� | �¶ȡ� | ��ʼn(CCl4)( mol) | ��ʼn(H2)( mol) | ƽ��ʱn(CHCl3)( mol) |
1 | 110 | 0.8 | 1.2 | |
2 | 110 | 2 | 2 | 1 |
3 | 100 | 1 | 1 | 0.6 |
�ٴ˷�Ӧ��110��ʱƽ�ⳣ��Ϊ___��
��ʵ��l�У�CCl4��ת����Ϊ__��
���жϸ÷�Ӧ������Ӧ��__��������������������������������__��
��Ϊ���ʵ��3��CCl4��ת���ʣ��ɲ�ȡ�Ĵ�ʩ��__��
a.ʹ�ø�Ч����
b.����������Ͷ��1molCCl4��1molH2
c.�¶����ߵ�200��
d.����������Ͷ��1molHCl
e.����������Ͷ��1molH2
���𰸡����� 2CH4(g)+4NO2(g)=2CO2(g)+2N2(g)+4H2O(g)��H=-1734kJ/mol 1 60% ���� �¶�Ϊ100��ʱ��K=2.25������110��ʱ��ƽ�ⳣ����˵�������¶ȣ���Ӧ�����ƶ�����ÿ��淴Ӧ������ӦΪ���ȷ�Ӧ e
��������
��2���漰��ѧƽ�ⳣ���ļ��㣬���ݻ�ѧƽ�ⳣ��ֻ���¶��йأ��¶Ȳ��䣬��ѧƽ�ⳣ�����䣬�ݴ˽��м��������
��1���ɷ�Ӧ���̣�2��ͼ��֪����Ӧ��������С�������������������Է�Ӧ���̣�2�����ȣ��ɷ�Ӧ���̣�1��ͼ��֪����Ӧ���̣�1�����Ȼ�ѧ����ʽ��CH4(g)+4NO2(g)=CO2(g)+4NO(g)+2H2O(g) ��H=-574kJ/mol�٣��ɷ�Ӧ���̣�2��ͼ��֪����Ӧ���̣�2�����Ȼ�ѧ����ʽ��![]() CO2(g)+N2(g)+H2O(g) =
CO2(g)+N2(g)+H2O(g) =![]() CH4(g)+2NO(g) ��H=+580kJ/mol�ڣ�
CH4(g)+2NO(g) ��H=+580kJ/mol�ڣ�![]() �ã�2CH4(g)+4NO2(g)=2CO2(g)+2N2(g)+4H2O(g) ��H=
�ã�2CH4(g)+4NO2(g)=2CO2(g)+2N2(g)+4H2O(g) ��H=![]() ���ʴ�Ϊ�����ȣ�2CH4(g)+4NO2(g)=2CO2(g)+2N2(g)+4H2O(g) ��H=-1734kJ/mol��
���ʴ�Ϊ�����ȣ�2CH4(g)+4NO2(g)=2CO2(g)+2N2(g)+4H2O(g) ��H=-1734kJ/mol��
��2�������á�����ʽ�����м��㣺
�ɱ������ݿ�֪��110��ʱ��c(CHCl3)=![]() �������У�
��������
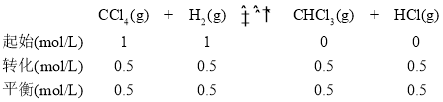
��ƽ�ⳣ��K=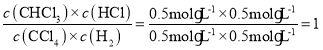 ���ʴ�Ϊ��1��
���ʴ�Ϊ��1��
���ɱ������ݿ�֪��ʵ��1��ʵ��2�¶���ͬ������ߵĻ�ѧƽ�ⳣ��Ҳ��ͬ�������У���ʼc(CCl4)=![]() ��c(H2)=
��c(H2)=![]() ����CCl4��ת����Ϊa����
����CCl4��ת����Ϊa����

��ƽ�ⳣ��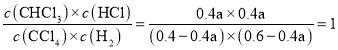 ����ã�a=0.6���ʴ�Ϊ��60%��
����ã�a=0.6���ʴ�Ϊ��60%��
���ɱ������ݿ�֪����100��ʱ��c(CCl4)=![]() ��c(H2)=
��c(H2)=![]() ��ƽ��ʱc(CHCl3)=
��ƽ��ʱc(CHCl3)=![]() ������������ʽ���������£�
������������ʽ���������£�
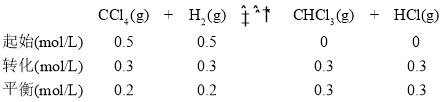
��ƽ�ⳣ��K=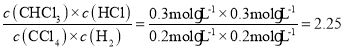 ��1�����¶�Ϊ100��ʱ��K=2.25������110��ʱ��ƽ�ⳣ����˵�������¶ȣ���Ӧ�����ƶ�����ÿ��淴Ӧ������ӦΪ���ȷ�Ӧ���ʴ�Ϊ�����ȣ��¶�Ϊ100��ʱ��K=2.25������110��ʱ��ƽ�ⳣ����˵�������¶ȣ���Ӧ�����ƶ�����ÿ��淴Ӧ������ӦΪ���ȷ�Ӧ��
��1�����¶�Ϊ100��ʱ��K=2.25������110��ʱ��ƽ�ⳣ����˵�������¶ȣ���Ӧ�����ƶ�����ÿ��淴Ӧ������ӦΪ���ȷ�Ӧ���ʴ�Ϊ�����ȣ��¶�Ϊ100��ʱ��K=2.25������110��ʱ��ƽ�ⳣ����˵�������¶ȣ���Ӧ�����ƶ�����ÿ��淴Ӧ������ӦΪ���ȷ�Ӧ��
��a��ʹ�ø�Ч������ƽ�ⲻ�ƶ���CCl4
b������������Ͷ��1molCCl4��1molH2�����ݵ�Чƽ�⣬��ѧƽ�ⲻ�ƶ���CCl4��ת���ʲ��䣬b�����
c���¶����ߵ�200�棬ƽ�������ƶ���CCl4��ת���ʼ�С��c�����
d������������Ͷ��1molHCl��ƽ�������ƶ���CCl4��ת���ʼ�С��d�����
e������������Ͷ��1molH2��ƽ�������ƶ���CCl4��ת��������e����ȷ��
��ѡ��e��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A.����ƿ����Ͳ�͵ζ����϶�����ʹ���¶ȣ���Ͳ������ƿ�� ��0���̶ȣ��ζ�������0���̶ȣ�ʹ��ʱ�ζ���ˮϴ������ϴ��������ƿˮϴ������ϴ
B.�õ�����ƽ������ѧҩƷʱ�������ȳ�С�ձ����������ٳ��������Լ����������������֮�ΪҩƷ������
C.�����Ż�ʱ������ϸɳ������𣻵����豸����Ļ��֣���������ĭ��������
D.��4mL0.1mol��L-1��K2Cr2O7��Һ�еμ�����1mol��L-1��NaOH��Һ����Һ��ɫ�ӳ�ɫ��ɻ�ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס��ҡ���������������ѧ��ѧ������������мס��Ҿ�Ϊ���ʣ����ǵ�ת����ϵ��ͼ��ʾ(ijЩ�����Ͳ��ֲ�������ȥ)������˵������ȷ����
(����)��
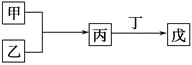
A. ����ɼס��ҵ�Ԫ��λ��ͬһ���ڣ����������һ������
B. ����ɼס��ҵ�Ԫ��λ��ͬһ���壬���������һ������
C. ����Ϊ��������ԭ�Ӱ뾶��������Ԫ���γɵĵ��ʣ�����Ϊ����ֻ��ΪNa2O2
D. ��������������ɰ��̣��ұ�Ϊ18���ӷ��ӣ���Ϊ10���ӷ��ӣ����ҵ�ˮ��Һ���ܾ���Ư������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�����״��ij��÷����ǣ�CO(g)+2H2(g)=CH3OH(g) ��H1=-90.8 kJ/mol��
��֪��2H2(g)+O2(g)=2H2O(1) ��H2=-571.6 kJ/mol
H2(g)+![]() O2(g)=H2O(g) ��H3=-241.8 kJ/mol
O2(g)=H2O(g) ��H3=-241.8 kJ/mol
�����й�˵����ȷ����
A. H2��ȼ����Ϊ241. 8 kJ/mol
B. CH3OH(g)+O2(g)=CO(g)+2H2O(g) ��H=-392. 8 kJ/mol
C. ��![]() ���ȱ�ʾ���Ӹ���Ҳ�ܱ�ʾ���ʵ���
���ȱ�ʾ���Ӹ���Ҳ�ܱ�ʾ���ʵ���
D. δע���¶Ⱥ�ѹǿʱ����H��ʾ��״���µ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�����ƶ�����ͭ�ᾧˮ������ʵ�飬��д���пհף�
ʵ�鲽��Ϊ������ĥ����ȷ��ȡ2.0g�Ѿ����������ͭ���壻�ۼ��ȣ�����ȴ���ݳ��������ظ������ݵIJ�����ֱ�����������߸���ʵ�����ݼ�������ͭ������ᾧˮ�ĺ�������ش�������⣺
(1)�������Ҫ��ʵ��������____________���������Ҫʹ�õ�������____________��ʹ�ô�������Ŀ���Ƿ�ֹ��ˮ����ͭ����ȴ���������տ����е�ˮ������
(2)��������õĴ���������ͼ���ڿո����������������ƣ�
�������λ�ظ������ݵIJ�����ֱ��_______________________________________
(3)ijѧ��ʵ���õ��������ݣ�
����ǰ���� | ���Ⱥ����� | |
m1�������� | m2������+���壩 | m3������+��ˮ����ͭ�� |
5.400 | 7.900 | 6.800 |
���㣺����ⶨ1mol����ͭ����Ľᾧˮ��x=_________________________________��
����ʵ���������Ϊ______________________��������2λС����
(4)��������ȷ����ʵ���õ�����ͭ������ᾧˮ�ĺ���ƫ�͡���ԭ�������__________�����ţ�
A������Ʒ�к��м��Ȳ��ӷ������� B������Ʒ�к��м����ӷ�������
Cʵ��ǰ������Ʒ���в���ʧˮ D����ǰ���õ�����δ��ȫ����
(5)���������ⶨ�̷���FeSO4xH2O���нᾧˮ����������ʧˮʱ���벻��ͨ�뵪����װ����ͼ��
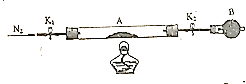
˵����Ӧ�����ڵ��������е�ԭ��
_________________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25�桢101kPaʱ��C(s)��H2(g)��CH3COOH(l)��ȼ���ȷֱ�Ϊ393.5kJ/mol��285.8kJ/mol��870.3kJ/mol����2C(s)+2H2(g)+O2(g)= CH3COOH(l)���ʱ�Ϊ�� ��
A.-488.3kJ/molB.+488.3kJ/molC.+191kJ/molD.-191kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϴӵ�⾫��ͭ��������(��������ͭ�����ȵ���)����ȡ����ʪ�������������£�
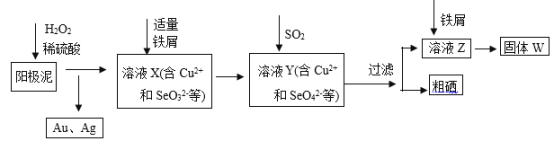
(1)����ҺX�м�����м��������______ ���˲����в��ܼ���������۵�ԭ����______��
(2)������ҺZ�������ӵIJ���������______��
(3)���˲�����Ҫ�õ��������������������õ���������ʵ��������______��
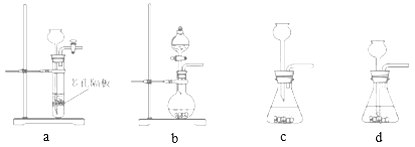
(4)ʵ��������ȡSO2��ԭ��Ϊ��Na2SO3+H2SO4=Na2SO4+H2O+SO2�����˴�Ӧʹ��______(������Ũ������������ϡ������)��ԭ���� ______����ȡSO2��װ�ã����ѡ����ͼ�е�______��
(5)���������ĺ����������·����ⶨ��
��Se+2H2SO4(Ũ)=2SO2��+SeO2+2H2O
��SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O
��I2+2Na2S2O3=Na2S4O6+2NaI
ͨ����Na2S2O3����Һ(�Լ���)�ζ���Ӧ�������ɵ�I2���������ĺ������ζ��������õ��IJ���������_______��ʵ����ȷ����0.1200g������Ʒ���ζ�������0.2000mol/L��Na2S2O3��Һ27.60mL���������Ʒ��������������Ϊ_______ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1200��ʱ����Ȼ���������лᷢ�����з�Ӧ��
H2S��g��+3/2 O2��g���TSO2��g��+H2O��g�� ��H1
2H2S��g��+SO2��g���T3/2 S2��g��+2H2O��g�� ��H2
H2S��g��+1/2 O2��g���TS��g��+H2O��g�� ��H3
2S��g���TS2��g�� ��H4
���H4����ȷ����ʽΪ�� ��
A.��H4=3/2����H1-��H2-3��H3��B.��H4=2/3 ��3��H3-��H1-��H2��
C.��H4=3/2����H1+��H2-3��H3��D.��H4=2/3 ����H1+��H2-3��H3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�ϴ�����![]() ��ZnS��CuS��������
��ZnS��CuS��������![]() ��ijʵ��С���Էϴ���Ϊԭ�ϣ�����п��ͭ�����ʵ���������£���֪��CuS�Ȳ�����ϡ���ᣬҲ����ϡ���ᷴӦ������˵����ȷ����
��ijʵ��С���Էϴ���Ϊԭ�ϣ�����п��ͭ�����ʵ���������£���֪��CuS�Ȳ�����ϡ���ᣬҲ����ϡ���ᷴӦ������˵����ȷ����
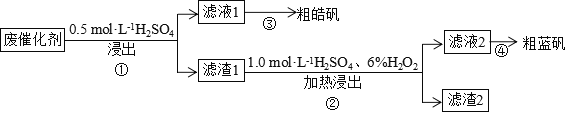
A.��Һ1���Ƿ���![]() ������ѡ��KSCN�����Ƶ���ˮ����
������ѡ��KSCN�����Ƶ���ˮ����
B.����![]() �����У��ȼ�
�����У��ȼ�![]()
![]() ���ڲ��Ͻ����£��ټ���
���ڲ��Ͻ����£��ټ���![]()
![]()
C.����1�ɷ���![]() ��CuS������2�ɷ�һ����
��CuS������2�ɷ�һ����![]()
D.����![]() �����У����ɵ���������NaOH��Һ��
�����У����ɵ���������NaOH��Һ��![]() ��Һ����
��Һ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com