
【题目】工业生产甲醇的常用方法是:CO(g)+2H2(g)=CH3OH(g) △H1=-90.8 kJ/mol。
已知:2H2(g)+O2(g)=2H2O(1) △H2=-571.6 kJ/mol
H2(g)+![]() O2(g)=H2O(g) △H3=-241.8 kJ/mol
O2(g)=H2O(g) △H3=-241.8 kJ/mol
下列有关说法正确的是
A. H2的燃烧热为241. 8 kJ/mol
B. CH3OH(g)+O2(g)=CO(g)+2H2O(g) △H=-392. 8 kJ/mol
C. “![]() ”既表示分子个数也能表示物质的量
”既表示分子个数也能表示物质的量
D. 未注明温度和压强时,△H表示标准状况下的数据
【答案】B
【解析】A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;B、依据盖斯定律和热化学方程式计算得到;C、热化学方程式前的计量数只能表示物质的量;D、△H表示在25℃,101KPa条件下测定的数据。
A、根据燃烧热概念,结合热化学方程式,2H2(g)+O2(g)=2H2O (l)△H=-571.6kJ·mol-1,氢气的燃烧热为:H2(g)+1/2O2(g)=H2O (l)△H=-285.8kJ·mol-1,所以氢气的燃烧热为285.8KJ·mol-1,故A错误;B、(1)CO(g)+2H2(g)=CH3OH(g) △H1=-90.8 kJ/mol.(2)H2(g)+![]() O2(g)=H2O(g) △H3=-241.8 kJ/mol;(2)×2-(1)得到: CH3OH(g)+O2(g)=CO(g)+2H2O(g) △H=-392. 8 kJ/mol,故B正确;C、“
O2(g)=H2O(g) △H3=-241.8 kJ/mol;(2)×2-(1)得到: CH3OH(g)+O2(g)=CO(g)+2H2O(g) △H=-392. 8 kJ/mol,故B正确;C、“![]() ”不表示分子个数,只能表示物质的量,故C错误;D、热化学方程式未注明温度和压强时,△H表示在25℃,101KPa条件下测定的数据,故D错误;故选B。
”不表示分子个数,只能表示物质的量,故C错误;D、热化学方程式未注明温度和压强时,△H表示在25℃,101KPa条件下测定的数据,故D错误;故选B。


 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
【题目】原子的吸收光谱是线状的而不是连续的,主要原因是( )
A. 原子中电子的能量高低 B. 外界条件的影响
C. 原子轨道的能量是量子化的 D. 仪器设备的工作原理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学反应中,只有极少数能量比平均能量高得多的反应物分子发 生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用 kJ/mol 表示。请认真观察下图,然后 回答问题。

(1)图中所示反应是_____(填“吸热”或“放热”)反应。
(2)已知拆开 1mol H—H 键、1mol I—I、1mol H—I 键分别需要吸收的能量为 436kJ、151kJ、299kJ。则由 1mol 氢气和 1mol 碘反应生成 HI 会_____(填“放出”或“吸 收”)______kJ 的热量。在化学反应过程中,是将_____转化为_________。
(3)下列反应中,属于放热反应的是_____,属于吸热反应的是_____。
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳
⑤食物因氧化而腐败 ⑥Ba(OH)2·8H2O 与 NH4Cl 反应 ⑦铁粉与稀盐酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实骑,能达到实验目的的是
选项 | A | B | C | D |
实验装置 |
|
|
|
|
实验目的 | 完成“喷泉”实验 | 测定中和热 | 制取并收集干燥纯净的NH3 | 制取NO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E的原子序数依次增大,其中E不属于短周期元素,常见单质分子B2中含有3对共用电子对,D的最外层电子数是周期序数的2倍,E单质是一种紫红色金属,甲、乙、丙是上述部分元素组成的二元化合物.且乙、丙分子所含电子总数相同,转化关系如图所示,其中甲是黑色固体,丙是一种常见的无色液体。下列说法不正确的是
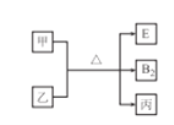
A. 乙分子中共用电子对数目与B2分子相同
B. 单质D与E在加热时可生成1:1型化合物
C. 原子半径:B>C
D. C与D位于同一主族,与B位于同一周期
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究.其结构简式如图.下列关于分枝酸的叙述正确的是( ) 
A.分子中含有2种官能团
B.可与乙醇、乙酸反应,且反应类型相同
C.1mol分枝酸最多可与3molNaOH发生中和反应
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属锰主要用在航空、冶金及化工等行业。采用“两矿一步法”浸出高硫高铁碳酸锰矿(主要含有FeS2、FeCO3、SiO2、CuO等杂质)制备金属锰的工艺流程如下:
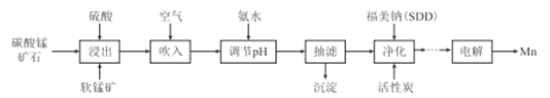
已知:Ⅰ.福美钠的化学式为(CH3)2CNS2Na,采用福美钠对MnSO4溶液中重金属进行净化去除效果良好:
Ⅱ.部分金属离子形成氢氧化物沉淀的pH如下表所示:
Fe2+ | Cu2+ | Fe3+ | Mn2+ | |
pH(开始沉淀) | 7.5 | 5.2 | 1.7 | 7.2 |
pH(完全沉淀) | 9.7 | 7.8 | 3.2 | 10.4 |
回答下列问题:
(1)FeS2中S元素的化合价为_____价。
(2)浸出时,软锰矿中的主要成分MnO2与FeS2发生氧化还原反应,写出该反应的化学方程式:___
(3)向浸出液中吹入空气的目的是__________(用离子方程式表示)。
(4)调节pH的最佳范围是_______,沉淀的成分是______(填化学式)。
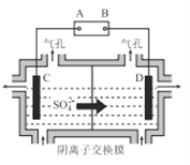
(5)(CH3)2CNS2H可由(CH3)2NH与CS2通过加成反应得到,1mol(CH3)2NH中,共价键的数目为__NA。
(6)工业上采用如图所示的方法获得金属Mn,B极为____极,若没有阴离子交换膜,Mn2+将在D极发生反应生成MnO2,则电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行两组电解实验。
实验一:已知固体电解质只有特定离子才能移动。按照下图装置研究α-AgI固体电解质导体是Ag+导电还是I-导电;

实验二:用惰性电极电解硫酸铜和盐酸混合液,对产生的气体进行研究。
关于以上实验,下列说法正确的是
A. 实验一:若α-AgI固体是Ag+导电,则通电一段时间后的晶体密度不均匀
B. 实验一:若α-AgI固体是I-导电,则通电一段时间后的晶体密度仍均匀
C. 实验二:若阳极为纯净气体,阴、阳两极产生的气体体积比可能≥1
D. 实验二:若阳极为混合气体,阴、阳两极产生的气体体积比可能≥1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是( )
A. 表示1 LpH=2的CH3COOH溶液加水稀释至V L,pH随lgV的变化
表示1 LpH=2的CH3COOH溶液加水稀释至V L,pH随lgV的变化
B. 表示不同温度下水溶液中H+和OH﹣浓度的变化的曲线,图中温度T2<T1
表示不同温度下水溶液中H+和OH﹣浓度的变化的曲线,图中温度T2<T1
C.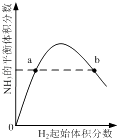 表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点
表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点
D. 表示同一温度下,在不同容积的容器中进行反应2NO2(g)2NO(g)+O2(g),O2的平衡浓度与容器容积的关系
表示同一温度下,在不同容积的容器中进行反应2NO2(g)2NO(g)+O2(g),O2的平衡浓度与容器容积的关系
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com