
����Ŀ������ͼʾ���Ӧ��������������ǣ�������
A. ��ʾ1 LpH=2��CH3COOH��Һ��ˮϡ����V L��pH��lgV�ı仯
��ʾ1 LpH=2��CH3COOH��Һ��ˮϡ����V L��pH��lgV�ı仯
B. ��ʾ��ͬ�¶���ˮ��Һ��H+��OH��Ũ�ȵı仯�����ߣ�ͼ���¶�T2��T1
��ʾ��ͬ�¶���ˮ��Һ��H+��OH��Ũ�ȵı仯�����ߣ�ͼ���¶�T2��T1
C.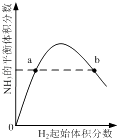 ��ʾһ�������µĺϳɰ���Ӧ�У�NH3��ƽ�����������H2��ʼ���������N2����ʼ���㶨���ı仯��ͼ��a��N2��ת����С��b��
��ʾһ�������µĺϳɰ���Ӧ�У�NH3��ƽ�����������H2��ʼ���������N2����ʼ���㶨���ı仯��ͼ��a��N2��ת����С��b��
D. ��ʾͬһ�¶��£��ڲ�ͬ�ݻ��������н��з�Ӧ2NO2��g��2NO��g��+O2��g����O2��ƽ��Ũ���������ݻ��Ĺ�ϵ
��ʾͬһ�¶��£��ڲ�ͬ�ݻ��������н��з�Ӧ2NO2��g��2NO��g��+O2��g����O2��ƽ��Ũ���������ݻ��Ĺ�ϵ
���𰸡�A
���������⣺A��������������Һ�д��ڵ���ƽ�⣬��ˮϡ��ƽ��������У���ϡ��10n������ҺPH������ֵС��n��ͼ�������������10n����ҺPH����n����λ�����ܱ�ʾ������ƽ��������еı仯��ͼ�����Aѡ��
B��ˮ�ĵ�����������ȹ��̣����ȴٽ�����ƽ��������У�������Ũ����������������Ũ�ȼ�С��һ���¶��´������ӻ��������¶�Խ�������Ӻ�����������Ũ��Խ��T2��T1��ͼ��仯��������Ũ�ȱ仯����B��ѡ��
C�����ַ�Ӧ������һ�ֻ������һ�����ʵ�ת���ʣ��������������������ת������������ͼ��a��N2��ת����С��b�㣬ͼ��仯����ת���ʱ仯����C��ѡ��
D.2NO2��g��2NO��g��+O2��g������Ӧ�������������ķ�Ӧ�����Խ��ѹǿԽС��ƽ���������������ķ������У�������У�����������Ũ��Ӱ�����������ƽ��Ũ�ȼ�С��ͼ��仯���Ϸ�Ӧ�仯����D��ѡ��
��ѡA��
�����㾫�����������������ˮ��Һ�еĵ���ƽ�����Ŀ�����жϼ��ɵõ��𰸣���Ҫ��֪��������ʷ����������ӵ����ʵ��ڽ�ϳɷ��ӵ�����ʱ��������ʵĵ���ʹ��ڵ���ƽ��״̬������ƽ���ǻ�ѧƽ���һ�֣�ͬ�����л�ѧƽ��������������ı�ʱƽ���ƶ��Ĺ��ɷ�����ɳ����ԭ����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�����״��ij��÷����ǣ�CO(g)+2H2(g)=CH3OH(g) ��H1=-90.8 kJ/mol��
��֪��2H2(g)+O2(g)=2H2O(1) ��H2=-571.6 kJ/mol
H2(g)+![]() O2(g)=H2O(g) ��H3=-241.8 kJ/mol
O2(g)=H2O(g) ��H3=-241.8 kJ/mol
�����й�˵����ȷ����
A. H2��ȼ����Ϊ241. 8 kJ/mol
B. CH3OH(g)+O2(g)=CO(g)+2H2O(g) ��H=-392. 8 kJ/mol
C. ��![]() ���ȱ�ʾ���Ӹ���Ҳ�ܱ�ʾ���ʵ���
���ȱ�ʾ���Ӹ���Ҳ�ܱ�ʾ���ʵ���
D. δע���¶Ⱥ�ѹǿʱ����H��ʾ��״���µ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ����������ʯī������1 L 1 molL��1ʳ��ˮ�У�����˵����ȷ���ǣ������� 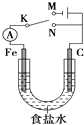
A.�����K��N���ӣ������������ḯʴ
B.�����K��N���ӣ�������Ӧʽ��4OH����4e��=2H2O+O2��
C.�����K��M���ӣ���ʯī������ͭ������ʵ�������϶�ͭ
D.�����K��M���ӣ�������������28 L����״������ʱ��������1 mol NaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ��Һ�ȿ�����ǿ�����ֿ�����ǿ���ԣ��ڸ���Һ��һ���ܴ�������������ǣ� ��
A.H+ Na+ NO3�� SO42��
B.Na+ CO32�� Cu2+ Cl��
C.K+ Na+ Cl�� SO42��
D.K+ Cl�� Ba2+ HCO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ�� ![]() +
+ ![]()
![]()
![]() ���Ҫ�ϳɻ�����A����ṹΪ��
���Ҫ�ϳɻ�����A����ṹΪ�� ![]() ����˵������ȷ���ǣ�������
����˵������ȷ���ǣ�������
A.������A��HBr �������ʵ���1��1�ӳ�ʱ�������ֲ�ͬ�IJ���
B.�÷�Ӧ��ԭ���Ǽӳɷ�Ӧ
C.�ϳ�A��ԭ�Ͽ����ǣ���Ȳ��2��3��������1��3������ϩ
D.�ϳ�A��ԭ�Ͽ����ǣ�2����Ȳ��2������1��3������ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����³�ѹ�£�������ͬ������O2��O3������˵����ȷ���ǣ� ��
A.ԭ����֮��Ϊ1:1B.������֮��Ϊ1:1
C.�ܶ�֮��Ϊ1:1D.���֮��Ϊ1:1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������¡����ݵ��ܱ������н��������������淴Ӧ��(��)2X(g)![]() Y(g)+Z(s)�� (��)A(s)+2B(g)
Y(g)+Z(s)�� (��)A(s)+2B(g)![]() C(g)+D(g)�����������������ٷ����仯ʱ�����Ա������Ҿ��ﵽƽ��״̬����
C(g)+D(g)�����������������ٷ����仯ʱ�����Ա������Ҿ��ﵽƽ��״̬����
�ٻ�������ܶ�
�ڷ�Ӧ������������İٷֺ���
�۷�Ӧ����������������������������֮�ȵ��ڻ�ѧ������֮��
�ܻ�������ѹǿ
�ݹ�������
�������������ʵ���
A���٢ڢۢܢݢ� B���٢ڢۢ� C���٢ڢ� D���ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ճ������г��������ӵ�ʳ����������������������������Ҷ��������������������Ʒ������ĵ⡢����������Ӧ����Ϊ�� ��
A.Ԫ��B.����C.����D.������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���綯�������ҹ���Ѹ�ͷ�չ��������ﮣ�LiFePO4������ǵ綯�������õ�һ�ֵ�أ��乤��ԭ������ͼ��ʾ���м��Ǿۺ���ĸ�Ĥ�������븺������������ӿ���ͨ�������Ӳ���ͨ�����õ�ص��ܷ�Ӧʽ����LiFePO4+C6 ![]() Li1-xFePO4+LixC6 ������˵������ȷ����
Li1-xFePO4+LixC6 ������˵������ȷ����
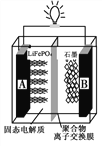
A. �ŵ�ʱ���Ӵ�A��ͨ����������B��
B. ���ʱLi����A��������B����
C. ���ʱB���缫��ӦʽΪ��C6+xLi++xe��===LixC6
D. �ŵ�ʱA���缫��ӦʽΪ��Li1-xFePO4+xLi++ xe��=== LiFePO4
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com