
【题目】电动汽车在我国正迅猛发展,磷酸铁锂(LiFePO4)电池是电动汽车常用的一种电池,其工作原理如下图所示。中间是聚合物的隔膜把正极与负极隔开,锂离子可以通过而电子不能通过。该电池的总反应式是:LiFePO4+C6 ![]() Li1-xFePO4+LixC6 。下列说法不正确的是
Li1-xFePO4+LixC6 。下列说法不正确的是
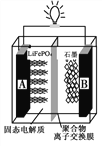
A. 放电时电子从A极通过导线流向B极
B. 充电时Li+从A极区移向B极区
C. 充电时B极电极反应式为:C6+xLi++xe-===LixC6
D. 放电时A极电极反应式为:Li1-xFePO4+xLi++ xe-=== LiFePO4
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是( )
A. 表示1 LpH=2的CH3COOH溶液加水稀释至V L,pH随lgV的变化
表示1 LpH=2的CH3COOH溶液加水稀释至V L,pH随lgV的变化
B. 表示不同温度下水溶液中H+和OH﹣浓度的变化的曲线,图中温度T2<T1
表示不同温度下水溶液中H+和OH﹣浓度的变化的曲线,图中温度T2<T1
C.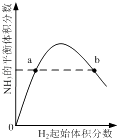 表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点
表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点
D. 表示同一温度下,在不同容积的容器中进行反应2NO2(g)2NO(g)+O2(g),O2的平衡浓度与容器容积的关系
表示同一温度下,在不同容积的容器中进行反应2NO2(g)2NO(g)+O2(g),O2的平衡浓度与容器容积的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消除氮氧化物和硫氧化物有多种方法。
(1)用活性炭还原法: 某研究小组向某密闭容器中加入足量的活性炭和 NO,发生反应:C(s)+2NO(g) ![]() N2(g)+CO2(g) H=Q kJ·mol-1 在 T1℃下,反应进行到不同时间测得各物质的浓度部分数据如下:
N2(g)+CO2(g) H=Q kJ·mol-1 在 T1℃下,反应进行到不同时间测得各物质的浓度部分数据如下:

①0~10 min 内, N2 的平均反应速率 υ(N2)=________ , T1℃时,该反应的平衡常数 K=_____。
②30 min 后,若只改变一个条件,反应重新达到平衡时各物质的浓度如上表所示,则改变的条件可能是____________ (填字母)
a. 加入一定量的活性炭 b. 改变反应体系的温度
c. 缩小容器的体积 d. 通入一定量的 NO
③若 30 min 后升高温度至 T2℃,重新达到平衡时,容器中 NO、 N2、 CO2 的浓度之比为 7∶3∶3,则该反应的H______0(填“>” 、 “ =” 、或“<” )
(2)NH3 催化还原法: 原理如图所示
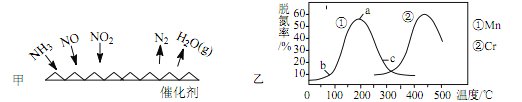
①若烟气中 c(NO2): c(NO)=1∶1,发生如图甲所示的脱氮反应时,反应过程中转移 1.5mol 电子时放出的热量为 113.8 kJ,则发生该脱氮反应的热化学方程式为_____ 。
②图乙是在一定时间内,使用不同催化剂 Mn 和 Cr 在不同温度下对应的脱氮率,由图可知工业使用的最佳催化剂和相应温度分别为_____ ;使用 Mn 作催化剂时,脱氮率 b~a 段呈现如图变化的可能原因是_____。
(3)已知常温下 Ka1(H2SO3)=1.810-2, Ka2(H2SO3)=6.010-9。 汽车尾气中的 SO2 用石灰水来吸收,生成的 CaSO3 浊液 pH=9.0,忽略 SO32-的第二步水解,则Ksp(CaSO3)=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可用于合成除草剂和杀虫剂。一定条件下,恒容密闭容器中,发生反应H2S(g)+CO2(g) ![]() COS(g)+H2O(g),能充分说明该反应已经达到化学平衡状态的是
COS(g)+H2O(g),能充分说明该反应已经达到化学平衡状态的是
A. 正、逆反应速率都等于零
B. H2S、CO2、COS、H2O的浓度相等
C. H2S、 CO2、COS、H2O的浓度不再变化
D. H2S、CO2、COS、H2O在密闭容器中共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列六个说法中,正确的有
①已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为ΔH=-241.8 kJ·mol-1
②由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
③X(g)+Y(g) ![]() Z(g)+W(g) ΔH>0,恒温恒容条件下达到平衡后加入X,上述反应的ΔH增大
Z(g)+W(g) ΔH>0,恒温恒容条件下达到平衡后加入X,上述反应的ΔH增大
④已知:
共价键 | C—C | C=C | C—H | H—H |
键能/(kJ·mol-1) | 348 | 610 | 413 | 436 |
根据上表数据可以计算出C6H6(g)+3H2(g)→C6H12(g)的焓变
⑤根据盖斯定律,推知在相同条件下,金刚石或石墨燃烧生成1 mol CO2固体时,放出的热量相等
⑥25 ℃、101 kPa时,1 mol碳完全燃烧生成CO2所放出的热量为碳的燃烧热
A. 1个 B. 2个 C. 3个 D. 4个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫是生物必须的营养元素之一,含硫化合物在自然界中广泛存在,循环关系如下图所示:
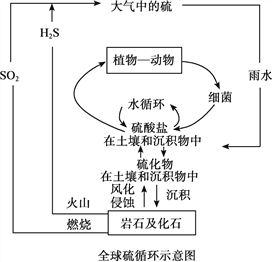
(1)火山喷发产生H2S在大气当中发生如下反应:
①2H2S(g)+O2(g)=2S(g)+2H2O(g) △H=﹣442.38kJ/mol
②S(g)+O2(g)=SO2(g) △H=﹣297.04kJ/mol。
H2S(g)与O2(g)反应产生SO2(g)和H2O(g)的热化学方程式是__________。
(2)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透遇到难溶的ZnS,慢慢转变为铜蓝(CuS),请从沉淀溶解平衡的角度解释由ZnS转变为CuS的过程__________。
(3)化石燃料燃烧时会产生含SO2的废气进入大气,污染环境,有多种方法可用于SO2的脱除。
①氨法脱硫。该方法是一种高效低耗能的湿法脱硫方式,利用氨水吸收废气中的SO2,并在富氧条件下氧化为硫酸铵,得到化肥产品。反应的化学方程式是__________。
②NaClO碱性溶液吸收法。工业上可用NaClO碱性溶液吸收SO2。反应离子方程式是__________。为了提高吸收效率,常用Ni2O3作为催化剂。在反应过程中产生的四价镍和原子氧具有极强的氧化能力,可加快对SO2的吸收。该催化过程的示意图如下图所示:
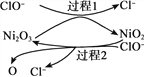
过程1:Ni2O3 +ClO- = 2NiO2 +Cl-,过程2的离子方程式是__________。
Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO更好,原因是__________。
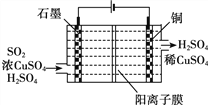
③电化学脱硫法。某种电化学脱硫法装置如下图所示,不仅可脱除SO2还可得到Cu。电解过程中发生总反应的离子方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,Na2CO3溶液存在水解平衡:CO32﹣+H2OHCO3﹣+OH﹣ . 下列说法正确的是( )
A.稀释溶液,水解平衡常数增大
B.通入CO2 , 平衡朝正反应方向移动
C.升高温度, ![]() 减小
减小
D.加入NaOH固体,溶液pH减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com