
【题目】硫是生物必须的营养元素之一,含硫化合物在自然界中广泛存在,循环关系如下图所示:
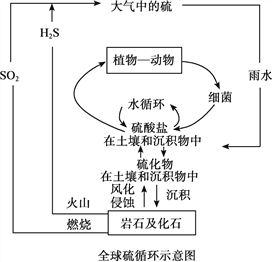
(1)火山喷发产生H2S在大气当中发生如下反应:
①2H2S(g)+O2(g)=2S(g)+2H2O(g) △H=﹣442.38kJ/mol
②S(g)+O2(g)=SO2(g) △H=﹣297.04kJ/mol。
H2S(g)与O2(g)反应产生SO2(g)和H2O(g)的热化学方程式是__________。
(2)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透遇到难溶的ZnS,慢慢转变为铜蓝(CuS),请从沉淀溶解平衡的角度解释由ZnS转变为CuS的过程__________。
(3)化石燃料燃烧时会产生含SO2的废气进入大气,污染环境,有多种方法可用于SO2的脱除。
①氨法脱硫。该方法是一种高效低耗能的湿法脱硫方式,利用氨水吸收废气中的SO2,并在富氧条件下氧化为硫酸铵,得到化肥产品。反应的化学方程式是__________。
②NaClO碱性溶液吸收法。工业上可用NaClO碱性溶液吸收SO2。反应离子方程式是__________。为了提高吸收效率,常用Ni2O3作为催化剂。在反应过程中产生的四价镍和原子氧具有极强的氧化能力,可加快对SO2的吸收。该催化过程的示意图如下图所示:
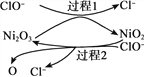
过程1:Ni2O3 +ClO- = 2NiO2 +Cl-,过程2的离子方程式是__________。
Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO更好,原因是__________。
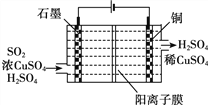
③电化学脱硫法。某种电化学脱硫法装置如下图所示,不仅可脱除SO2还可得到Cu。电解过程中发生总反应的离子方程式是__________。
【答案】 2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) △H=﹣1036.46kJ/mol ZnS(s)![]() Zn2+(aq)+S2—(aq),与Cu2+结合生成更难溶的CuS,使平衡右移 4NH3·H2O +2SO2+O2===2(NH4)2SO4+2H2O ClO-+SO2+2OH- =Cl-+SO42-+H2O 2NiO2+ClO- ===Ni2O3 +Cl-+2O Ca2+与SO42—结合生成难溶的CaSO4,有利于反应的进行 2H2O +Cu2++SO2
Zn2+(aq)+S2—(aq),与Cu2+结合生成更难溶的CuS,使平衡右移 4NH3·H2O +2SO2+O2===2(NH4)2SO4+2H2O ClO-+SO2+2OH- =Cl-+SO42-+H2O 2NiO2+ClO- ===Ni2O3 +Cl-+2O Ca2+与SO42—结合生成难溶的CaSO4,有利于反应的进行 2H2O +Cu2++SO2![]() Cu+SO42—+4H+
Cu+SO42—+4H+
【解析】(1)①2H2S(g)+O2(g)=2S(g)+2H2O(g)△H=﹣442.38kJ/mol,②S(g)+O2(g)=SO2(g)△H=﹣297.04kJ/mol,根据盖斯定律,将①+②×2得:2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) △H=(﹣442.38kJ/mol)+(﹣297.04kJ/mol)×2=﹣1036.46kJ/mol,故答案为:2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) △H=﹣1036.46kJ/mol;
(2)ZnS(s)![]() Zn2+(aq)+S2—(aq),与Cu2+结合生成更难溶的CuS,使平衡右移,因此自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透遇到难溶的ZnS,慢慢转变为铜蓝(CuS),故答案为:ZnS(s)
Zn2+(aq)+S2—(aq),与Cu2+结合生成更难溶的CuS,使平衡右移,因此自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透遇到难溶的ZnS,慢慢转变为铜蓝(CuS),故答案为:ZnS(s)![]() Zn2+(aq)+S2—(aq),与Cu2+结合生成更难溶的CuS,使平衡右移;
Zn2+(aq)+S2—(aq),与Cu2+结合生成更难溶的CuS,使平衡右移;
(3)①利用氨水吸收废气中的SO2,并在富氧条件下氧化为硫酸铵,反应的化学方程式为,4NH3·H2O +2SO2+O2=2(NH4)2SO4+2H2O故答案为:4NH3·H2O +2SO2+O2=2(NH4)2SO4+2H2O;
②用NaClO碱性溶液吸收SO2,次氯酸钠将二氧化硫氧化生成硫酸,反应离子方程式是ClO-+SO2+2OH- =Cl-+SO42-+H2O;为了提高吸收效率,常用Ni2O3作为催化剂。根据催化过程的示意图可知,过程2中NiO2和ClO-反应生成Ni2O3、Cl-、O,离子方程式为2NiO2+ClO- =Ni2O3 +Cl-+2O;Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO更好,是因为Ca2+与SO42—结合生成难溶的CaSO4,有利于反应的进行,故答案为:ClO-+SO2+2OH- =Cl-+SO42-+H2O;2NiO2+ClO- =Ni2O3 +Cl-+2O;Ca2+与SO42—结合生成难溶的CaSO4,有利于反应的进行;
③根据图示,二氧化硫与硫酸铜在通电作用下反应生成了硫酸和铜,反应的离子方程式为2H2O +Cu2++SO2![]() Cu+SO42—+4H+,故答案为:2H2O +Cu2++SO2
Cu+SO42—+4H+,故答案为:2H2O +Cu2++SO2![]() Cu+SO42—+4H+。
Cu+SO42—+4H+。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】在两个恒温、恒容的密闭容器中进行下列两个可逆反应:(甲)2X(g)![]() Y(g)+Z(s); (乙)A(s)+2B(g)
Y(g)+Z(s); (乙)A(s)+2B(g)![]() C(g)+D(g),当下列物理量不再发生变化时,可以表明甲和乙均达到平衡状态的是
C(g)+D(g),当下列物理量不再发生变化时,可以表明甲和乙均达到平衡状态的是
①混合气体密度
②反应容器中生成物的百分含量
③反应物的消耗速率与生成物的消耗速率之比等于化学计量数之比
④混合气体的压强
⑤固体质量
⑥混合气体的总物质的量
A.①②③④⑤⑥ B.①②③⑤ C.①②③ D.②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语表达正确的是
A. Na2O2的电子式:![]()
B. Al3+的结构示意图:![]()
C. CH3COOCH3的名称:乙酸甲酯
D. 用电子式表示氯化氢的形成过程:![]() +
+![]() →
→![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电动汽车在我国正迅猛发展,磷酸铁锂(LiFePO4)电池是电动汽车常用的一种电池,其工作原理如下图所示。中间是聚合物的隔膜把正极与负极隔开,锂离子可以通过而电子不能通过。该电池的总反应式是:LiFePO4+C6 ![]() Li1-xFePO4+LixC6 。下列说法不正确的是
Li1-xFePO4+LixC6 。下列说法不正确的是
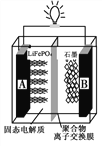
A. 放电时电子从A极通过导线流向B极
B. 充电时Li+从A极区移向B极区
C. 充电时B极电极反应式为:C6+xLi++xe-===LixC6
D. 放电时A极电极反应式为:Li1-xFePO4+xLi++ xe-=== LiFePO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在298 K时,实验测得溶液中的反应H2O2+2HI===2H2O+I2在不同浓度时的化学反应速率如表所示,由此可推知第5组实验中c(HI)、c(H2O2)不可能为
实验编号 | 1 | 2 | 3 | 4 | 5 | 6 |
c(HI)/(mol·L-1) | 0.100 | 0.200 | 0.150 | 0.100 | ? | 0.500 |
c(H2O2)/(mol·L-1) | 0.100 | 0.100 | 0.150 | 0.200 | ? | 0.400 |
v/(mol·L-1·s-1) | 0.007 60 | 0.015 2 | 0.017 1 | 0.015 2 | 0.022 8 | 0.152 |
A. 0.150 mol·L-1、0.200 mol·L-1
B. 0.300 mol·L-1、0.100 mol·L-1
C. 0.200 mol·L-1、0.200 mol·L-1
D. 0.100 mol·L-1、0.300 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质的叙述,正确的是( )
A.NaCl溶液在电流作用下电离出Na+和Cl-
B.凡是溶于水后能电离出H+的化合物就叫酸
C.HCl溶液能导电,而液态的HCl难以导电
D.难溶物一定不属于电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解一定量的硫酸铜溶液,实验装置如下图甲。电解过程中的实验数据如下图乙,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体 积(标准状况)。则下列说法不正确的是
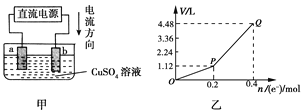
A. 电解过程中,a电极表面先有红色物质析出,后有气泡产生
B. b电极上发生反应的方程式为:4OH--4e-=2H2O+O2↑
C. 曲线O~P段表示O2的体积变化
D. 从开始到Q点时收集到的混合气体的平均摩尔质量为12 g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类对原子结构的认识经历了一个不断深入的过程,以下科学家以及他们提出的原子结构学说(或模型)对应关系正确的是 ( )
A.道尔顿——电子轨道理论B.卢瑟福——量子力学模型
C.玻尔——行星绕太阳模型D.汤姆逊——葡萄干面包模型
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种元素的原子,其价电子排布分别为4s2、3s2 3p2 和2s2 2p4,由这三种元素组成的化合物的化学式可能是
A.XYZ2 B.X2YZ3 C.X2YZ2 D.XYZ3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com