
【题目】常温常压下,对于相同质量的O2和O3,下列说法正确的是( )
A.原子数之比为1:1B.分子数之比为1:1
C.密度之比为1:1D.体积之比为1:1
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究.其结构简式如图.下列关于分枝酸的叙述正确的是( ) 
A.分子中含有2种官能团
B.可与乙醇、乙酸反应,且反应类型相同
C.1mol分枝酸最多可与3molNaOH发生中和反应
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C,D、E、G六种前四周期主族元素,已知A、B、C、D、E五种元素在元素周期表中的位置如图所示。

(1)若非金属元素B的核电荷数为x,则A、B、C、D、E五种元素的核电荷数之和为_________。
(2)若A、B、C、D四种元素的核内质子数之和为56,lmolG的单质与足量盐酸反应,能产生22. 4LH2(在标准状况下);G的阳离子与D的阴离子核外电子层结构相同。
①写出下列元素名称:A_________,B________;
②D的简单离子结构示意图为_________;
③氢化物的沸点:D_________B,简单氢化物水溶液的酸性:B_________C(填“>”“<”或“=”)。
④甲为G、C两元素组成的化合物,用电子式表示甲的形成过程_________。
(3)下列说法正确的是_________(填序号)
A.氢键是极弱的化学键,任何物质中都存在化学键
B.共价化合物中成键原子均满足稀有气体的稳定结构
C.两种非金属元素形成的化合物可能含有离子键
D.化学键断裂,一定发生化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据问题填空:
(1)25℃时,在0.1L 0.2molL﹣1的HA溶液中,有0.001mol的HA电离成离子,则该溶液的pH= .
(2)25℃时,若向0.1mol/L氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=amol/L,则c(SO42﹣)= .
(3)室温下,若向0.1mol/L氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,则所得溶液中各离子的物质的量浓度由大到小的顺序是 .
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量.已知:
化学式 | 电离常数(25℃) |
HCN | K=4.9×10﹣10 |
CH3COOH | K=1.8×10﹣5 |
H2CO3 | K1=4.3×l0﹣7、K2=5.6×10﹣11 |
回答下列问题
25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三溶液的pH由大到小的顺序为 .
向NaCN溶液中通入少量CO2 , 所发生反应的化学方程式为: .
(5)常温下,在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11.若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是( )
A. 表示1 LpH=2的CH3COOH溶液加水稀释至V L,pH随lgV的变化
表示1 LpH=2的CH3COOH溶液加水稀释至V L,pH随lgV的变化
B. 表示不同温度下水溶液中H+和OH﹣浓度的变化的曲线,图中温度T2<T1
表示不同温度下水溶液中H+和OH﹣浓度的变化的曲线,图中温度T2<T1
C.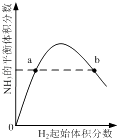 表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点
表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点
D. 表示同一温度下,在不同容积的容器中进行反应2NO2(g)2NO(g)+O2(g),O2的平衡浓度与容器容积的关系
表示同一温度下,在不同容积的容器中进行反应2NO2(g)2NO(g)+O2(g),O2的平衡浓度与容器容积的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通水泥在固化过程中其自由水分子减少并形成碱性溶液。根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为2Cu+Ag2O==Cu2O+2Ag,下列有关说法正确的是( )
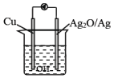
A. 测量原理示意图中,电子方向从Ag2O→Cu
B. 反应中有0.5 NA个电子转移时,析出0.5mol Cu2O
C. 正极的电极反应为Ag2O+2e- + H2O==2Ag+2OH-
D. 电池工作时,OH-离子浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有以下各组微粒或物质:A.正丁烷和异丁烷 B.金刚石、石墨和C60 C.冰和干冰 D.35Cl和37Cl E.NO和NO2;其中,互为同分异构体的有__________(填编号,以下同);互为同素异形体的有__________。
(2)现有:①干冰 ②金刚石 ③NH4Cl ④Na2S四种物质,按下列要求回答(填序号):熔化时不需要破坏化学键的是____________;既存在离子键又存在共价键的是____________。
(3)向一个容积为2 L的密闭容器中充入7 mol SO2和4 mol O2,在一定温度和压强下,发生如下反应:2SO2(g)+O2(g) 2SO3(g),经4 s后达到平衡状态,测得SO2的物质的量是3 mol,则达到平衡状态时O2的转化率为__________;平衡时SO3的物质的量浓度_______。
(4) NaBH4(s)与H2O(l)反应生成NaBO2(s)和氢气,在25 ℃、101 kPa下,已知每消耗3.8 g NaBH4(s)放热21.6 kJ,该反应的热化学方程式是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.1mol化合物 ![]() 分别与足量的浓溴水、足量的NaOH溶液反应,消耗Br2和NaOH的物质的量相等
分别与足量的浓溴水、足量的NaOH溶液反应,消耗Br2和NaOH的物质的量相等
B.等质量的乙醇、乙烯、甲烷分别充分燃烧,所耗用氧气的量依次减少
C.聚乳酸( ![]() )是由单体之间通过加聚反应合成的
)是由单体之间通过加聚反应合成的
D.实验证实 ![]() 可使溴的四氯化碳溶液褪色,说明该分子中存在碳碳双键
可使溴的四氯化碳溶液褪色,说明该分子中存在碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列六个说法中,正确的有
①已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为ΔH=-241.8 kJ·mol-1
②由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
③X(g)+Y(g) ![]() Z(g)+W(g) ΔH>0,恒温恒容条件下达到平衡后加入X,上述反应的ΔH增大
Z(g)+W(g) ΔH>0,恒温恒容条件下达到平衡后加入X,上述反应的ΔH增大
④已知:
共价键 | C—C | C=C | C—H | H—H |
键能/(kJ·mol-1) | 348 | 610 | 413 | 436 |
根据上表数据可以计算出C6H6(g)+3H2(g)→C6H12(g)的焓变
⑤根据盖斯定律,推知在相同条件下,金刚石或石墨燃烧生成1 mol CO2固体时,放出的热量相等
⑥25 ℃、101 kPa时,1 mol碳完全燃烧生成CO2所放出的热量为碳的燃烧热
A. 1个 B. 2个 C. 3个 D. 4个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com