
����Ŀ��(1)�����¸����������ʣ�A.��������춡�顡B.���ʯ��ʯī��C60��C.���ɱ���D.35Cl��37Cl��E.NO��NO2�����У���Ϊͬ���칹�����__________(���ţ�����ͬ)����Ϊͬ�����������__________��
(2)���У��ٸɱ����ڽ��ʯ����NH4Cl����Na2S�������ʣ�������Ҫ��ش�(�����)���ۻ�ʱ����Ҫ�ƻ���ѧ������____________���ȴ������Ӽ��ִ��ڹ��ۼ�����____________��
(3)��һ���ݻ�Ϊ2 L���ܱ������г���7 mol SO2��4 mol O2����һ���¶Ⱥ�ѹǿ�£��������·�Ӧ��2SO2(g)��O2(g) 2SO3(g)����4 s��ﵽƽ��״̬�����SO2�����ʵ�����3 mol����ﵽƽ��״̬ʱO2��ת����Ϊ__________��ƽ��ʱSO3�����ʵ���Ũ��_______��
(4) NaBH4(s)��H2O(l)��Ӧ����NaBO2(s)����������25 �桢101 kPa�£���֪ÿ����3.8 g NaBH4(s)����21.6 kJ���÷�Ӧ���Ȼ�ѧ����ʽ��____________________________��
���𰸡� A B �� �� 50% 2 mol��L-1 NaBH4(s)+2H2O(l)==NaBO2(s)+4H2(g) ��H=��216.0kJ��mol-1
��������(1)ͬ���칹����ָ����ʽ��ͬ,���ṹ��ͬ���л�������,��ͬ����������ָ��ͬ��Ԫ����ɵIJ�ͬ������
(2)���Ӿ����ۻ�����Ҫ�ƻ���ѧ��,ԭ�Ӿ����ۻ�ʱ��Ҫ�ƻ����ۼ�,���Ӿ����ۻ�ʱ��Ҫ�ƻ����Ӽ������ۼ�Ϊ�ǽ���ԭ��֮���γɵĻ�ѧ�������Ӽ�Ϊ��������֮���γɵĻ�ѧ�����������ʵ���ɽ����ж���
(3)���ݷ�Ӧ�б仯�����ʵ���֮�ȵ��ڻ�ѧ������֮��,�����Ӧ�����������ʵ���,Ȼ�����ת����=ת����/��ʼ����100%����������ݷ���ʽ,�����SO3�����ʵ���,������c=![]() ���� SO3�����ʵ���Ũ����
���� SO3�����ʵ���Ũ����
(4)n(NaBH4)=![]() =0.1mol, ��25 �桢101 kPa�£���֪ÿ����0.1mol NaBH4(s)����21.6 kJ��������1mol NaBH4����216.0kJ��������ʵ�״̬���ʱ���д�Ȼ�ѧ����ʽ��
=0.1mol, ��25 �桢101 kPa�£���֪ÿ����0.1mol NaBH4(s)����21.6 kJ��������1mol NaBH4����216.0kJ��������ʵ�״̬���ʱ���д�Ȼ�ѧ����ʽ��
���:(1)A����������춡��ķ���ʽ����C4H10,���ṹ��ͬ����Ϊͬ���칹����
B�����ʯ��ʯī��C60������̼Ԫ����ɵ��������ڲ�ͬ�ĵ�������Ϊͬ����������
C�����ɱ��ijɷֱַ���ˮ��������̼�������ֲ�ͬ��������
D��35Cl��37Cl����������ͬ,��������ͬ��ԭ��,��Ϊͬ��Ԫ�صIJ�ͬ����,��Ϊͬλ����
E��.NO��NO2�����ֲ�ͬ��������
��ˣ�������ȷ����:A��B��
(2)���Ӿ����ۻ�����Ҫ�ƻ���ѧ��,�����ۻ�ʱ����Ҫ�ƻ���ѧ���������ɱ���
�ڽ��ʯ����NH4Cl����Na2S�ֱ�����ԭ�Ӿ��塢���Ӿ��塢���Ӿ���,�ۻ�ʱ��Ҫ�ƻ����ۼ������Ӽ������Ӽ���
���ɱ���̼��֮���γɹ��ۼ��������ʯ��̼̼֮���γɹ��ۼ�����NH4Cl�������Ӻ�笠�����֮��������Ӽ���笠������е�ԭ�Ӻ���ԭ��֮����ڹ��ۼ�����Na2S����������������֮���γ����Ӽ���
��ˣ�������ȷ����:�٣��ۣ�
(3)��һ���ݻ�Ϊ2L���ܱ������г���7 mol SO2��4 mol O2����һ���¶Ⱥ�ѹǿ�£��������·�Ӧ��2SO2(g)��O2(g) 2SO3(g)����4s��ﵽƽ��״̬,���SO2�����ʵ�����3mol,��Ӧ��SO2�����ʵ�����4mol,��Ӧ�б仯�����ʵ���֮�ȵ��ڻ�ѧ������֮��,�������ĵ����������ʵ���Ϊ2mol,
ƽ��״̬ʱO2��ת����Ϊ![]() ��100%=50%��
��100%=50%��
�μӷ�Ӧ��SO2�����ʵ���Ϊ7mol-3mol=4mol,���ݷ���ʽ2SO2(g)��O2(g) 2SO3(g)
����֪��,���ɵ�SO3�����ʵ������ڲμӷ�Ӧ��SO2�����ʵ���,
ƽ��ʱSO3�����ʵ���Ũ��Ϊ![]() =2mol/L��
=2mol/L��
��ˣ�������ȷ������50% ��2 mol��L-1 ��
��4��n(NaBH4)=![]() =0.1mol, ��25 �桢101 kPa�£���֪ÿ����0.1mol NaBH4(s)����21.6 kJ��������1mol NaBH4����216.0kJ�����Ȼ�ѧ����ʽΪNaBH4(s)+2H2O(l)==NaBO2(s)+4H2(g) ��H=��216.0kJ��mol-1��
=0.1mol, ��25 �桢101 kPa�£���֪ÿ����0.1mol NaBH4(s)����21.6 kJ��������1mol NaBH4����216.0kJ�����Ȼ�ѧ����ʽΪNaBH4(s)+2H2O(l)==NaBO2(s)+4H2(g) ��H=��216.0kJ��mol-1��
��ˣ�������ȷ����: NaBH4(s)+2H2O(l)==NaBO2(s)+4H2(g) ��H=��216.0kJ��mol-1��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���A�Ľṹ��ʽΪ ![]() ������ͨ����ͬ��ѧ��Ӧ�ֱ��Ƶ�B��C��D�������ʣ�
������ͨ����ͬ��ѧ��Ӧ�ֱ��Ƶ�B��C��D�������ʣ� 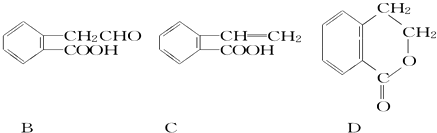
��1��B�к��������ŵ������� ��
��2��A��C�ķ�Ӧ��������A��D�л�Ϊͬ���칹����� ��
��3����A����B�Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ��Һ�ȿ�����ǿ�����ֿ�����ǿ���ԣ��ڸ���Һ��һ���ܴ�������������ǣ� ��
A.H+ Na+ NO3�� SO42��
B.Na+ CO32�� Cu2+ Cl��
C.K+ Na+ Cl�� SO42��
D.K+ Cl�� Ba2+ HCO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����³�ѹ�£�������ͬ������O2��O3������˵����ȷ���ǣ� ��
A.ԭ����֮��Ϊ1:1B.������֮��Ϊ1:1
C.�ܶ�֮��Ϊ1:1D.���֮��Ϊ1:1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������¡����ݵ��ܱ������н��������������淴Ӧ��(��)2X(g)![]() Y(g)+Z(s)�� (��)A(s)+2B(g)
Y(g)+Z(s)�� (��)A(s)+2B(g)![]() C(g)+D(g)�����������������ٷ����仯ʱ�����Ա������Ҿ��ﵽƽ��״̬����
C(g)+D(g)�����������������ٷ����仯ʱ�����Ա������Ҿ��ﵽƽ��״̬����
�ٻ�������ܶ�
�ڷ�Ӧ������������İٷֺ���
�۷�Ӧ����������������������������֮�ȵ��ڻ�ѧ������֮��
�ܻ�������ѹǿ
�ݹ�������
�������������ʵ���
A���٢ڢۢܢݢ� B���٢ڢۢ� C���٢ڢ� D���ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������ԭ��Ӧ���з�Ӧ��������ﹲ���֣�NO��FeSO4��Fe��NO3��3��H2O��HNO3��Fe2��SO4��3 �� ����HNO3Ϊ��Ӧ���÷�Ӧ�еĻ�ԭ��Ϊ�� ��
A.NO
B.BFeSO4
C.Fe��NO3��3
D.Fe2��SO4��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ճ������г��������ӵ�ʳ����������������������������Ҷ��������������������Ʒ������ĵ⡢����������Ӧ����Ϊ�� ��
A.Ԫ��B.����C.����D.������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ǽ�����ĺϽ��仯�������Ź㷺����;��
��1����ֺϽ��Ӳ������ͨ�ֲĵ� 4 ��������Ҫ�ɷ������� ������̬��ԭ�ӵļ۵����Ų�ͼ_____��
��2��������(NH3BH3)��һ�����ʹ�����ϣ�������д�����λ���� ��������ӽṹʽΪ_____��д��һ���백���黥Ϊ�ȵ�����ķ���_____(�ѧʽ)��
��3�����³�ѹ������(H3BO3)����ṹΪ��״�����άƽ��ṹ����ͼ��ʾ��
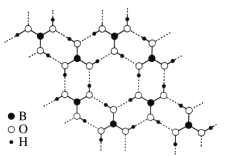
��1 mol H3BO3�������______mol �����
���������ĽǶȽ�����������ˮ�е��ܽ��С������ʱ�ܽ�������ԭ��__________��
��4�����⻯����һ�ֳ��õĻ�ԭ�����侧���ṹ����ͼ��ʾ��

�ٸþ�����Na+����λ��Ϊ_____��
��H3BO3 �����е� O��B��O �ļ���_____��������������������������С������ BH4���е� H��B��H �ļ��ǣ��ж�������_____��
����֪���⻯�ƾ�����ܶ�Ϊ �� g/cm3�� NA��������٤��������ֵ���� a=_____(�ú� �ѡ� NA�Ĵ���ʽ��ʾ)���������⻯�ƾ������µ��Ĵ��� Na+�� Li+ȡ�����õ��ľ���Ļ�ѧʽΪ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڵ���ʵ���������ȷ���ǣ� ��
A.NaCl��Һ�ڵ��������µ����Na+��Cl-
B.��������ˮ���ܵ����H+�Ļ�����ͽ���
C.HCl��Һ�ܵ��磬��Һ̬��HCl���Ե���
D.������һ�������ڵ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com