
【题目】有机物A的结构简式为 ![]() ,它可通过不同化学反应分别制得B、C和D三种物质.
,它可通过不同化学反应分别制得B、C和D三种物质. 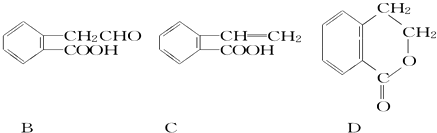
(1)B中含氧官能团的名称是 .
(2)A→C的反应类型是;A~D中互为同分异构体的是 .
(3)由A生成B的化学方程式是 .
 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】对含氮物质的研究和利用有着极为重要的意义.
(1)N2、O2和H2相互之间可以发生化合反应,已知反应的热化学方程式如下: N2(g)+O2(g)=2NO(g)△H=+180kJmol﹣1;
2H2(g)+O2(g)=2H2O(g)△H=﹣483kJmol﹣1;
N2(g)+3H2(g)=2NH3(g)△H=﹣93kJmol﹣1 .
则氨的催化氧化反应的热化学方程式为 .
(2)汽车尾气净化的一个反应原理为:2NO(g)+2CO(g)N2(g)+2CO2(g)△H<0. 一定温度下,将2.8mol NO、2.4mol CO通入固定容积为2L的密闭容器中,反应过程中部分物质的物质的量变化如图1所示.
①NO的平衡转化率为 , 0~20min平均反应速率v(NO)为mol/(Lmin);该温度下的化学平衡常数数值是 . 25min时,若保持反应温度不变,再向容器中充入CO、N2各0.8mol,则化学平衡将 移动(填“向左”、“向右”或“不”).
②下列可说明该反应已经达到平衡的是 .
a. v生成(CO2)=v消耗(CO)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.单位时间内消耗2n mol CO2的同时生成n mol N≡N
e.NO、CO、N2、CO2的浓度相等
③反应达到平衡后,改变某一个条件,如图2曲线①⑧中正确的是 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实骑,能达到实验目的的是
选项 | A | B | C | D |
实验装置 |
|
|
|
|
实验目的 | 完成“喷泉”实验 | 测定中和热 | 制取并收集干燥纯净的NH3 | 制取NO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究.其结构简式如图.下列关于分枝酸的叙述正确的是( ) 
A.分子中含有2种官能团
B.可与乙醇、乙酸反应,且反应类型相同
C.1mol分枝酸最多可与3molNaOH发生中和反应
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属锰主要用在航空、冶金及化工等行业。采用“两矿一步法”浸出高硫高铁碳酸锰矿(主要含有FeS2、FeCO3、SiO2、CuO等杂质)制备金属锰的工艺流程如下:
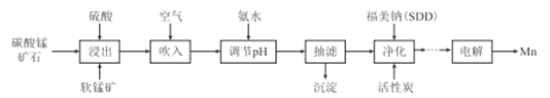
已知:Ⅰ.福美钠的化学式为(CH3)2CNS2Na,采用福美钠对MnSO4溶液中重金属进行净化去除效果良好:
Ⅱ.部分金属离子形成氢氧化物沉淀的pH如下表所示:
Fe2+ | Cu2+ | Fe3+ | Mn2+ | |
pH(开始沉淀) | 7.5 | 5.2 | 1.7 | 7.2 |
pH(完全沉淀) | 9.7 | 7.8 | 3.2 | 10.4 |
回答下列问题:
(1)FeS2中S元素的化合价为_____价。
(2)浸出时,软锰矿中的主要成分MnO2与FeS2发生氧化还原反应,写出该反应的化学方程式:___
(3)向浸出液中吹入空气的目的是__________(用离子方程式表示)。
(4)调节pH的最佳范围是_______,沉淀的成分是______(填化学式)。
(5)(CH3)2CNS2H可由(CH3)2NH与CS2通过加成反应得到,1mol(CH3)2NH中,共价键的数目为__NA。
(6)工业上采用如图所示的方法获得金属Mn,B极为____极,若没有阴离子交换膜,Mn2+将在D极发生反应生成MnO2,则电极反应式为____________。
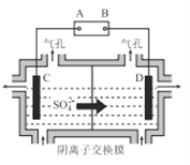
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,下列叙述正确的是
A. 标准状况下,1.12 L CCl4含有质子数的数目为3.7NA
B. 常温常压下,3.0 g含葡萄糖的冰醋酸中含有的原子总数为0.4NA
C. 常温时,56g Fe与足量浓硝酸反应,转移的电子数目为3NA
D. 晶体B的结构单元如右图 ,则11g晶体B含有0.6NA个三角形(相邻原子构成)
,则11g晶体B含有0.6NA个三角形(相邻原子构成)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行两组电解实验。
实验一:已知固体电解质只有特定离子才能移动。按照下图装置研究α-AgI固体电解质导体是Ag+导电还是I-导电;

实验二:用惰性电极电解硫酸铜和盐酸混合液,对产生的气体进行研究。
关于以上实验,下列说法正确的是
A. 实验一:若α-AgI固体是Ag+导电,则通电一段时间后的晶体密度不均匀
B. 实验一:若α-AgI固体是I-导电,则通电一段时间后的晶体密度仍均匀
C. 实验二:若阳极为纯净气体,阴、阳两极产生的气体体积比可能≥1
D. 实验二:若阳极为混合气体,阴、阳两极产生的气体体积比可能≥1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C,D、E、G六种前四周期主族元素,已知A、B、C、D、E五种元素在元素周期表中的位置如图所示。

(1)若非金属元素B的核电荷数为x,则A、B、C、D、E五种元素的核电荷数之和为_________。
(2)若A、B、C、D四种元素的核内质子数之和为56,lmolG的单质与足量盐酸反应,能产生22. 4LH2(在标准状况下);G的阳离子与D的阴离子核外电子层结构相同。
①写出下列元素名称:A_________,B________;
②D的简单离子结构示意图为_________;
③氢化物的沸点:D_________B,简单氢化物水溶液的酸性:B_________C(填“>”“<”或“=”)。
④甲为G、C两元素组成的化合物,用电子式表示甲的形成过程_________。
(3)下列说法正确的是_________(填序号)
A.氢键是极弱的化学键,任何物质中都存在化学键
B.共价化合物中成键原子均满足稀有气体的稳定结构
C.两种非金属元素形成的化合物可能含有离子键
D.化学键断裂,一定发生化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有以下各组微粒或物质:A.正丁烷和异丁烷 B.金刚石、石墨和C60 C.冰和干冰 D.35Cl和37Cl E.NO和NO2;其中,互为同分异构体的有__________(填编号,以下同);互为同素异形体的有__________。
(2)现有:①干冰 ②金刚石 ③NH4Cl ④Na2S四种物质,按下列要求回答(填序号):熔化时不需要破坏化学键的是____________;既存在离子键又存在共价键的是____________。
(3)向一个容积为2 L的密闭容器中充入7 mol SO2和4 mol O2,在一定温度和压强下,发生如下反应:2SO2(g)+O2(g) 2SO3(g),经4 s后达到平衡状态,测得SO2的物质的量是3 mol,则达到平衡状态时O2的转化率为__________;平衡时SO3的物质的量浓度_______。
(4) NaBH4(s)与H2O(l)反应生成NaBO2(s)和氢气,在25 ℃、101 kPa下,已知每消耗3.8 g NaBH4(s)放热21.6 kJ,该反应的热化学方程式是____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com