
【题目】NA代表阿伏加德罗常数的值,下列叙述正确的是
A. 标准状况下,1.12 L CCl4含有质子数的数目为3.7NA
B. 常温常压下,3.0 g含葡萄糖的冰醋酸中含有的原子总数为0.4NA
C. 常温时,56g Fe与足量浓硝酸反应,转移的电子数目为3NA
D. 晶体B的结构单元如右图 ,则11g晶体B含有0.6NA个三角形(相邻原子构成)
,则11g晶体B含有0.6NA个三角形(相邻原子构成)
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】关于下列装置说法正确的是( ) 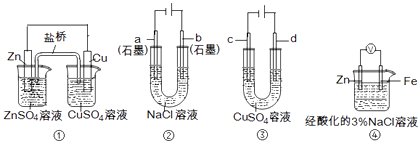
A.装置①中,盐桥中的K+移向ZnSO4溶液
B.装置②工作一段时间后,a极附近溶液的pH增大
C.用装置③精炼铜时,c极为粗铜
D.装置④中电子由Zn流向Fe,装置中有Fe2+生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课题小组将二氧化硫的制备与多个性质实验进行了一体化设计,实验装置如图所示。下列说法不正确的是
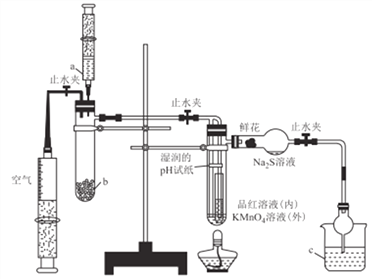
A. a、b、c中依次盛装70%硫酸.Na2SO3固体、NaOH溶液
B. 实验时,湿润的pH试纸、鲜花、品红溶液、KMnO4溶液均褪色,Na2S溶液出现淡黄色沉淀
C. 此设计可证明SO2水溶液的酸性,SO2的氧化性、还原性、漂白性
D. 点燃酒精灯加热,可证明SO2使品红溶液褪色具有可逆性,使KMnO4溶液褪色不具有可逆性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积不变的密闭容器中发生化学反应:Fe2O3(s) +2NH3(g)![]() 2Fe(s)+N2(g)+3H2O(g) △H,实验测得化学平衡时的有关变化曲线如图所示。已知:平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数。下列说法不正确的是
2Fe(s)+N2(g)+3H2O(g) △H,实验测得化学平衡时的有关变化曲线如图所示。已知:平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数。下列说法不正确的是
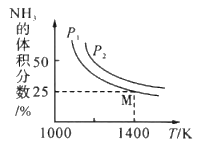
A. 该反应的△H>0
B. 气体压强P2 >P1
C. 平衡后再加入Fe2O3,则NH3转化率增大
D. M点的平衡常数Kp=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A的结构简式为 ![]() ,它可通过不同化学反应分别制得B、C和D三种物质.
,它可通过不同化学反应分别制得B、C和D三种物质. 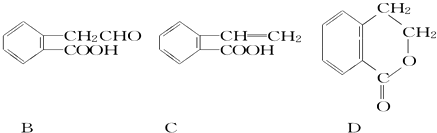
(1)B中含氧官能团的名称是 .
(2)A→C的反应类型是;A~D中互为同分异构体的是 .
(3)由A生成B的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热反应有广泛的用途,实验装置如下图1所示。下列说法正确的是

A. 铝热反应的能量变化可用图2表示
B. 工业上可用铝热反应的方法提取镁
C. 在铝热反应过程中没有涉及到的化学反应类型是化合反应
D. 该铝热反应的化学方程式是8Al+3Fe3O4![]() 4Al2O3+9Fe
4Al2O3+9Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率是描述化学反应进行快慢程度的物理量。某学生为了探究镁条与盐酸反应过程中反应速率的变化,利用如图装置测定一定时间内反应放出氢气的体积(加入稀盐酸的体积为100mL.忽略反应中溶液体积的变化),实验记录如下表(累计值):
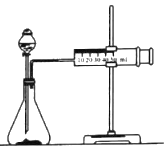
时间(min) | l | 2 | 3 | 4 | 5 | 6 |
氢气体积(mL)(标准状况) | 1 | 50 | 120 | 232 | 288 | 310 |
(1)除如图所示的实验用品外,还需要的一件实验仪器是_________。
(2)实验前,检查该装置气密性的方法是_________。
(3)装置气密性良好,0~lmin时间段氢气体积却很少的原因是_________。
(4)反应速率最大的时间段是_________min(填“0~1”1~2”2~3”3~4”“4~5”或“5~6”),原因是_________(从影响反应速率因素的角度解释)。
(5)3~4min时间段,以盐酸的浓度变化来表示的该反应速率为_________(设溶液体积不变)。
(6)由于反应太快,测量氢气体积时不好控制,他就事先在盐酸溶液中分别加入等体积的下列液体以减慢反应速率,你认为不可行的是_________(填相应字母)。
A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。
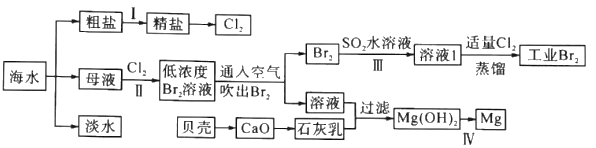
请回答下列问题:
(1)步骤I中,粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,精制时常用的试剂有:①稀盐酸;②氯化钡溶液;③氢氧化钠溶液;④碳酸钠溶液。下列加入试剂的顺序正确的是______(填字母)。
A.①②③④ B.②③④① C.②④③① D.③④②①
请写出加入Na2CO3溶液后相关化学反应的离子方程式:_________、_________。
(2)步骤Ⅱ中已获得Br2,步骤Ⅲ中又将Br2还原为Br-,其目的是_________。步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为_________。
(3)为了从工业Br2中提纯溴,除去产物中残留的少量Cl2.可向其中加入_________溶液。
(4)步骤Ⅳ由Mg(OH)2得到单质Mg,以下方法最合适的是_________(填序号)。
A. ![]()
B.![]()
C.![]()
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氧化还原反应中有反应物和生成物共六种:NO、FeSO4、Fe(NO3)3、H2O、HNO3和Fe2(SO4)3 . 其中HNO3为反应物,则该反应中的还原剂为( )
A.NO
B.BFeSO4
C.Fe(NO3)3
D.Fe2(SO4)3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com