
【题目】关于下列装置说法正确的是( ) 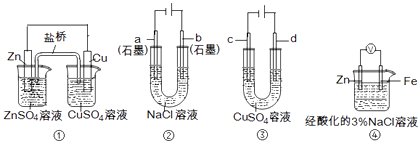
A.装置①中,盐桥中的K+移向ZnSO4溶液
B.装置②工作一段时间后,a极附近溶液的pH增大
C.用装置③精炼铜时,c极为粗铜
D.装置④中电子由Zn流向Fe,装置中有Fe2+生成
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,在下列溶液中可能大量共存的离子组是( )
A.pH=0的溶液:Fe2+、Mg2+、NO3﹣、SO42﹣
B.由水电离出的c(H+)=1×10﹣13mol/L的溶液:Al3+、K+、SO42﹣、Cl﹣
C.![]() =1012的溶液中:NH4+、Al3+、NO3﹣、CO32﹣
=1012的溶液中:NH4+、Al3+、NO3﹣、CO32﹣
D.pH=14的溶液:Na+、K+、Al3+、CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某手机电池采用了石墨烯电池,可充电5分钟,通话2小时。一种石墨烯锂硫电池(2Li+S8=Li2S8)工作原理示意图如图。下列有关该电池说法不正确的是
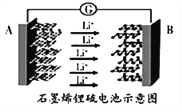
A. 金属锂是所有金属中比能量最高的电极材料
B. 充电时A电极为阴极,发生还原反应
C. 充电时B电极的反应:Li2S8-2e-=2Li++S8
D. 手机使用时电子从A电极经过手机电路版流向B电极,再经过电池电解质流回A电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定实验是化学学科中重要的定量实验. 已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下实验:
①称量1.0g样品溶于水,配成250mL溶液;
②准确量取25.00mL所配溶液于锥形瓶中;
③滴加几滴酚酞溶液;
④用0.1000mol/L的标准盐酸滴定三次,每次消耗盐酸的体积记录如表:
滴定序号 | 待测液体积(mL) | 所消耗标准盐酸的体积(mL) | |
滴定前 | 滴定后 | ||
① | 25.00 | 0.50 | 20.60 |
② | 25.00 | 6.00 | 26.00 |
③ | 25.00 | 1.10 | 21.00 |
请回答下列问题:
(1)滴定终点时的现象是 .
(2)所配制的250mL样品液中NaOH的物质的量浓度是 molL﹣1;试样中NaOH的质量分数为 .
(3)若出现下列情况,测定结果偏高的是 . a.滴定前用蒸馏水冲洗锥形瓶
b.在摇动锥形瓶时不慎将瓶内溶液溅出
c.滴定前有气泡,滴定后气泡消失
d.酸式滴定管滴至终点对,俯视读数
e.酸式滴定管用蒸馏水洗后,未用标准液润洗.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对含氮物质的研究和利用有着极为重要的意义.
(1)N2、O2和H2相互之间可以发生化合反应,已知反应的热化学方程式如下: N2(g)+O2(g)=2NO(g)△H=+180kJmol﹣1;
2H2(g)+O2(g)=2H2O(g)△H=﹣483kJmol﹣1;
N2(g)+3H2(g)=2NH3(g)△H=﹣93kJmol﹣1 .
则氨的催化氧化反应的热化学方程式为 .
(2)汽车尾气净化的一个反应原理为:2NO(g)+2CO(g)N2(g)+2CO2(g)△H<0. 一定温度下,将2.8mol NO、2.4mol CO通入固定容积为2L的密闭容器中,反应过程中部分物质的物质的量变化如图1所示.
①NO的平衡转化率为 , 0~20min平均反应速率v(NO)为mol/(Lmin);该温度下的化学平衡常数数值是 . 25min时,若保持反应温度不变,再向容器中充入CO、N2各0.8mol,则化学平衡将 移动(填“向左”、“向右”或“不”).
②下列可说明该反应已经达到平衡的是 .
a. v生成(CO2)=v消耗(CO)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.单位时间内消耗2n mol CO2的同时生成n mol N≡N
e.NO、CO、N2、CO2的浓度相等
③反应达到平衡后,改变某一个条件,如图2曲线①⑧中正确的是 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如表:下列说法错误的是( )
物质 | X | Y | Z |
初始浓度/molL﹣1 | 0.1 | 0.2 | 0 |
平衡浓度/molL﹣1 | 0.05 | 0.05 | 0.1 |
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y2Z
C.改变温度可以改变此反应的平衡常数
D.增大压强使平衡向生成Z的方向移动,平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能用离子方程式CO32﹣+2H+→CO2↑+H2O表示的是( )
A.Na2CO3+2HCl→2NaCl+CO2↑+H2O
B.NaHCO3+HCl→NaCl+CO2↑+H2O
C.K2CO3+H2SO4→K2SO4+CO2↑+H2O
D.K2CO3+2HNO3→2KNO3+CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,下列叙述正确的是
A. 标准状况下,1.12 L CCl4含有质子数的数目为3.7NA
B. 常温常压下,3.0 g含葡萄糖的冰醋酸中含有的原子总数为0.4NA
C. 常温时,56g Fe与足量浓硝酸反应,转移的电子数目为3NA
D. 晶体B的结构单元如右图 ,则11g晶体B含有0.6NA个三角形(相邻原子构成)
,则11g晶体B含有0.6NA个三角形(相邻原子构成)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com