
����Ŀ���Ժ������ʵ��о����������ż�Ϊ��Ҫ�����壮
��1��N2��O2��H2�֮����Է������Ϸ�Ӧ����֪��Ӧ���Ȼ�ѧ����ʽ���£� N2��g��+O2��g��=2NO��g����H=+180kJmol��1��
2H2��g��+O2��g��=2H2O��g����H=��483kJmol��1��
N2��g��+3H2��g��=2NH3��g����H=��93kJmol��1 ��
�Ĵ�������Ӧ���Ȼ�ѧ����ʽΪ ��
��2������β��������һ����Ӧԭ��Ϊ��2NO��g��+2CO��g��N2��g��+2CO2��g����H��0�� һ���¶��£���2.8mol NO��2.4mol COͨ��̶��ݻ�Ϊ2L���ܱ������У���Ӧ�����в������ʵ����ʵ����仯��ͼ1��ʾ��
��NO��ƽ��ת����Ϊ �� 0��20minƽ����Ӧ����v��NO��Ϊmol/��Lmin�������¶��µĻ�ѧƽ�ⳣ����ֵ�� �� 25minʱ�������ַ�Ӧ�¶Ȳ��䣬���������г���CO��N2��0.8mol����ѧƽ�⽫ �ƶ�������������ҡ���������
�����п�˵���÷�Ӧ�Ѿ��ﵽƽ����� ��
a�� v���ɣ�CO2��=v���ģ�CO��
b�����������ܶȲ��ٸı�
c����������ƽ����Է����������ٸı�
d����λʱ��������2n mol CO2��ͬʱ����n mol N��N
e��NO��CO��N2��CO2��Ũ�����
�۷�Ӧ�ﵽƽ��ı�ijһ����������ͼ2���ߢ�������ȷ���� 
���𰸡�
��1��4NH3��g��+5O2��g��=4NO��g��+6H2O��g����H=��903kJ?mol��1
��2��28.57%��0.02��0.05������ cd���٢ݢ�
���������⣺��1����֪����N2��g��+O2��g��=2NO��g����H=+180.5kJmol��1��
��2H2��g��+O2��g��=2H2O��g����H=��483kJmol��1��
��N2��g��+3H2��g��=2NH3��g����H=��93kJmol��1��
���ݸ�˹���ɣ��ڡ�3+�١�2���ۡ�2�ɵã�4NH3��g��+5O2��g��=4NO��g��+6H2O��g����H=[3������483kJmol��1��+��+180.5kJmol��1����2��2������93kJmol��1��]=��903kJmol��1��
���Դ��ǣ�4NH3��g��+5O2��g��=4NO��g��+6H2O��g����H=��903kJmol��1����2������ͼ��֪��20min����ƽ�⣬ƽ��ʱ���ɵ���Ϊ0.4mol���ɷ���ʽ��֪����NOΪ0.4mol��2=0.8mol��NOת����= ![]() ��100%=28.57%��v��NO��=
��100%=28.57%��v��NO��= ![]() =0.02mol/��Lmin���������ַ�Ӧ�¶Ȳ��䣬���������г���CO��N2��0.8mol��
=0.02mol/��Lmin���������ַ�Ӧ�¶Ȳ��䣬���������г���CO��N2��0.8mol��
2NO��g��+ | 2CO��g�� | N2��g��+ | 2CO2��g����H��0 | |
��ʼ��mol�� | 2.8 | 2.4 | 0 | 0 |
ת����mol�� | 0.8 | 0.8 | 0.4 | 0.8 |
ƽ�⣨mol�� | 2.0 | 1.6 | 0.4 | 0.8 |
��ѧƽ�ⳣ��Ϊ������Ũ��ϵ�����ݵij˻��뷴Ӧ��Ũ��ϵ�����ݳ˻��ı�ֵ�����¶��µĻ�ѧƽ�ⳣ��K= ![]() =
=  =0.05��25minʱ�������ַ�Ӧ�¶Ȳ��䣬���������г���CO��N2��0.8mol��
=0.05��25minʱ�������ַ�Ӧ�¶Ȳ��䣬���������г���CO��N2��0.8mol��
2NO��g��+ | 2CO��g�� | N2��g��+ | 2CO2��g�� |
2 | 1.6+0.8=2.4 | 0.8+0.4=1.2 | 0.4 |
Q=  =0.017��K��Ũ����Qc��K��ƽ�������ƶ���
=0.017��K��Ũ����Qc��K��ƽ�������ƶ���
���Դ��ǣ�28.57%��0.02mol/��Lmin����0.05������
��2NO��g��+2CO��g��N2��g��+2CO2��g����H��0��
a�� v���ɣ�CO2����ʾV����v���ģ�CO����ʾV�������Բ��ܱ�ʾ����ƽ�⣬��a����
b����Ӧǰ��Ϊ���壬���ܱ������У���Ӧǰ���������䣬���������ܶȦ�= ![]() ʼ�ձ��ֲ��䣬���Բ����жϣ���b����
ʼ�ձ��ֲ��䣬���Բ����жϣ���b����
c����Ӧǰ���������䣬����Ӧ������������С�����Ե���������ƽ����Է����������ٸı䣬���жϴﵽƽ�⣬��c��ȷ��
d����λʱ��������2n mol CO2�ı�ʾV�棬ͬʱ����n mol N��N��ʾV�����ҷ�����ϵ���ȣ����жϴﵽƽ�⣬��d��ȷ��
e���ﵽƽ�ⲻ�ر�������NO��CO��N2��CO2��Ũ����ȣ����Բ����жϴﵽƽ�⣬��e����
���Դ��ǣ�cd��
��ƽ�ⳣ��ֻ���¶�Ӱ�죬�����¶�ƽ�������ȷ�Ӧ�ƶ����÷�Ӧ����ӦΪ���ȷ�Ӧ���������¶�ƽ�����淴Ӧ�ƶ���ƽ�ⳣ����С���ʢ���ȷ�ڴ���
����ֻ�ı仯ѧ��Ӧ���ʣ����ı仯ѧƽ�⣬����ת���ʲ��䣬�ʢܴۢ���
ƽ�ⳣ��ֻ���¶�Ӱ�죬�¶Ȳ���ƽ�ⳣ�����䣬�����ʵ�Ũ���أ��ʢ���ȷ����
ѹǿ����ƽ��������У������������ʵ�����������Ũ��������ȷ�����
���������٢ݢ���ȷ��
���Դ��ǣ��٢ݢߣ�
�����㾫����������Ŀ����֪���������û�ѧƽ��״̬���ʼ������ͻ�ѧƽ��״̬���жϵ����֪ʶ���Եõ�����Ĵ𰸣���Ҫ���ջ�ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч����״̬�жϣ���v(B��)=v(B��)��v(C��):v(D��)=x : y��c(C)��C%��n(C)%�Ȳ������A��B��C��DΪ���壬��m+n��x+y��ѹǿ�㶨����ϵ��ɫ�����λʱ����ij�����ڻ�ѧ���Ķ����������γ�������ϵƽ��ʽ���㶨��m+n �� x+y���ȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������pH=2�Ĵ�����Һ��pH=2�������ң���������в���������⣺
��1��ȡ10mL�ļ���Һ������������ˮ������ĵ���ƽ��������������ҡ��������ƶ�����ȡ10mL�ļ���Һ������������ˮ�����ƹ��壨����������ǰ����Һ������ֲ��䣩���������������Һ�� ![]() �ı�ֵ�������������С������ȷ��������
�ı�ֵ�������������С������ȷ��������
��2����ͬ�����£�ȡ������ļס�������Һ����ϡ��100����ϡ�ͺ����Һ����pH��С��ϵΪ��pH���ף�pH���ң���������ڡ�����С�ڡ����ڡ�����ͬ��
��3����ȡ25mL�ļס�������Һ���ֱ��õ�Ũ�ȵ�NaOHϡ��Һ�к���pH=7�������ĵ�NaOH��Һ�������С��ϵΪ��V���ף�V���ң���
��4��ȡ25mL�ļ���Һ����������pH=12��NaOH��Һ����Ӧ����Һ��[Na+]��[CH3COO��]�Ĵ�С��ϵΪ��[Na+][CH3COO��]��
��5��ȡ25mL������Һ����������pH=12�İ�ˮ����Ӧ����Һ�е�����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڻ����ķ�����ᴿ�������õķ����У��ٹ��ˡ�����������������ȡ���ݼ��ȷֽ�ȣ����и������ķ�����ᴿӦ����ʲô������������ţ�
��1����ȡ��ˮ�еĵ� ��
��2����ȥʳ����Һ�е�ˮ ��
��3��������ˮ ��
��4����ȥKC1�����к��е�����KClO3 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ʵķ����У����������ǣ� ��
A.NaOH��ǿ�
B.CO2�������
C.H2SO4�����ᣩ
D.���ᣨ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ũ�Ⱦ�Ϊ0.1molL��1��������Һ�� ��Na2CO3��NaHCO3��HCl ��NH3H2O
��1�����˳���Һ�������۵ġ������ԭ�����������ӷ���ʽ���ͣ�
��2����������Һ��ˮ�ĵ���̶��ɴ�С��˳���ǣ��������д��
��3������м��������Ȼ�粒��壬��ʱ ![]() ��ֵ���������С�����䡱����
��ֵ���������С�����䡱����
��4���������Ϣۺܵ͢���Һ����ʱ��Һ��[NH4+]+[NH3H2O]=molL��1������ֵ������ʱ��Һ������Ũ�ȵĴ�С˳���ǣ��������ۺܵ͢���Һ��Ϻ���Һǡ�ó����ԣ�����ǰ�۵�����ܵ����������ڡ�С�ڡ����ڡ���
��5����10mL��Һ�ۼ�ˮϡ����100mL�����ʱ��Һ����ˮ�������c�� H+��= molL��1 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������װ��˵����ȷ���ǣ������� 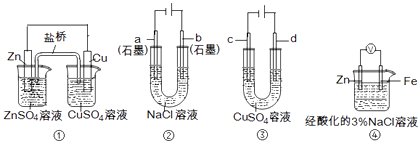
A.װ�â��У������е�K+����ZnSO4��Һ
B.װ�âڹ���һ��ʱ���a��������Һ��pH����
C.��װ�â۾���ͭʱ��c��Ϊ��ͭ
D.װ�â��е�����Zn����Fe��װ������Fe2+����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʹ����¯���ȣ�����ʹ�������ʾ������ȡ�����һ�¡��ٶȿ졢��Ч�ʸߵ��ŵ㡣�乤��ԭ����ͨ���¯�ڵ������Լ��ں��ȵĸ�Ƶ�ı���糡�ķ���ˮ���������Ѹ�ٰڶ���������ЧӦ��������Ϊ(����)
A. ˮ���Ӿ��м��Թ��ۼ� B. ˮ�����Ǽ��Է���
C. ˮ���⡢����Ԫ����� D. ˮ�������й��õ��Ӷ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ���۵�ߡ�Ӳ�ȴ����ԵĽ������㷺Ӧ���ڸ��������պ��졢��Դ������������Ŀǰ��ҵ��ʹ��һ���¹��գ��Ա��ұ�����Ĺ������һ��������ȡ��������������Ҫ����Fe2O3��Al2O3��V2O5��CuO�����幤������ͼ����:
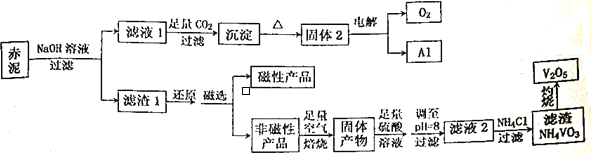
��֪:���ж��ּ�̬������+5�����ȶ���������Һ����Ҫ��VO2+��VO3-����ʽ���ڣ��Ҵ���ƽ��VO2++H2O![]() VO3-+2H+���ش���������:
VO3-+2H+���ش���������:
(1)���Բ�Ʒ�Ļ�ѧʽΪ_________________________��
(2)�������NaOH��Һ�����������ӷ�Ӧ����ʽΪ___________________���ܷ��ð�ˮ����NaOH��Һ��___________(��ܡ����ܡ�)��������___________________________________________��
(3)��Һ1���ɳ��������ӷ�Ӧ����ʽΪ_________________________________________��
(4)����pH=8��Ŀ����������һ��___________________������ʹVO2+ת��ΪVO3-����ʱ��Һ��VO2+��VO3-�����ʵ���֮��Ϊa:b��VO2++H2O![]() VO3-+2H+��ƽ�ⳣ��K=____________________��
VO3-+2H+��ƽ�ⳣ��K=____________________��
(5)��Һ2���Ȼ������NH4VO3�����ӷ���ʽΪ__________________________���÷�Ӧ�ܷ�������Ϊ__________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���A�Ľṹ��ʽΪ ![]() ������ͨ����ͬ��ѧ��Ӧ�ֱ��Ƶ�B��C��D�������ʣ�
������ͨ����ͬ��ѧ��Ӧ�ֱ��Ƶ�B��C��D�������ʣ� 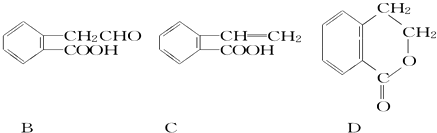
��1��B�к��������ŵ������� ��
��2��A��C�ķ�Ӧ��������A��D�л�Ϊͬ���칹����� ��
��3����A����B�Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com