
����Ŀ������һ���۵�ߡ�Ӳ�ȴ����ԵĽ������㷺Ӧ���ڸ��������պ��졢��Դ������������Ŀǰ��ҵ��ʹ��һ���¹��գ��Ա��ұ�����Ĺ������һ��������ȡ��������������Ҫ����Fe2O3��Al2O3��V2O5��CuO�����幤������ͼ����:
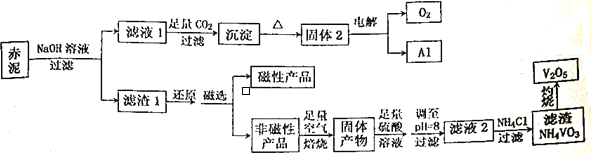
��֪:���ж��ּ�̬������+5�����ȶ���������Һ����Ҫ��VO2+��VO3-����ʽ���ڣ��Ҵ���ƽ��VO2++H2O![]() VO3-+2H+���ش���������:
VO3-+2H+���ش���������:
(1)���Բ�Ʒ�Ļ�ѧʽΪ_________________________��
(2)�������NaOH��Һ�����������ӷ�Ӧ����ʽΪ___________________���ܷ��ð�ˮ����NaOH��Һ��___________(��ܡ����ܡ�)��������___________________________________________��
(3)��Һ1���ɳ��������ӷ�Ӧ����ʽΪ_________________________________________��
(4)����pH=8��Ŀ����������һ��___________________������ʹVO2+ת��ΪVO3-����ʱ��Һ��VO2+��VO3-�����ʵ���֮��Ϊa:b��VO2++H2O![]() VO3-+2H+��ƽ�ⳣ��K=____________________��
VO3-+2H+��ƽ�ⳣ��K=____________________��
(5)��Һ2���Ȼ������NH4VO3�����ӷ���ʽΪ__________________________���÷�Ӧ�ܷ�������Ϊ__________________________________________��
���𰸡� Fe3O4 Al2O3+2OH==2A1O2+H2O ���� Al2O3�����ڰ�ˮ AlO2-+CO2+2H2O==Al(OH)3��+HCO3- ��ȥͭ����(�����Ȱ��������÷�) (b��10-16)/a VO3+NH4+=NH4VO3�� NH4VO3����
��������(1)������������������������ѧʽΪFe3O4 ����ȷ�𰸣�Fe3O4��
(2)����Ʒ�з�����֪��������Ҫ����Fe2O3��Al2O3��V2O5��CuO����������ǿ����Һ��Ӧ��ֻ������������Ӧ����ƫ�����ƺ�ˮ�����ӷ�Ӧ����ʽΪ��Al2O3+2OH-=2A1O-2+H2O��������ֻ����ǿ����ǿ�Ӧ���������Ӧ�����Բ����ð�ˮ����NaOH��Һ����ȷ�𰸣�Al2O3+2OH==2A1O2+H2O �� ���� ��Al2O3�����ڰ�ˮ��
(3) ��Һ1Ϊƫ��������Һ��ͨ�������Ķ�����̼��������������������̼�����������ӷ�Ӧ����ʽΪ��AlO2-+CO2+2H2O==Al(OH)3��+HCO3-����ȷ����AlO2-+CO2+2H2O==Al(OH)3��+HCO3-��
(4) ������Ҫ����Fe2O3��Al2O3��V2O5��CuO��������ܽ����������Ϊƫ�����ν�����Һ6�У�����������ԭΪ������ȥ������ͭ��ԭΪͭ�����������Ϊ����ͭ��Һ��������Һ��pH=8��ʹ��Һ�е�ͭ���ӱ�Ϊ��������ȥ������ƽ��VO2++H2O![]() VO3-+2H+����Һ��Ϊ���Ժ��к��������ӣ�ƽ�����ƣ�ʹVO2+ת��ΪVO3-����Һ��pH=8��c(OH-)=10-6mol/L, c(H+)=10-8 mol/L, ��ʱ��Һ��VO2+��VO3-�����ʵ���֮��Ϊa:b K=c(H+)2��c(VO3-)/ c( VO2+)=10-16��b/a������VO2++H2O
VO3-+2H+����Һ��Ϊ���Ժ��к��������ӣ�ƽ�����ƣ�ʹVO2+ת��ΪVO3-����Һ��pH=8��c(OH-)=10-6mol/L, c(H+)=10-8 mol/L, ��ʱ��Һ��VO2+��VO3-�����ʵ���֮��Ϊa:b K=c(H+)2��c(VO3-)/ c( VO2+)=10-16��b/a������VO2++H2O![]() VO3-+2H+��ƽ�ⳣ��K=(b��10-16)/a ����ȷ����(b��10-16)/a ��
VO3-+2H+��ƽ�ⳣ��K=(b��10-16)/a ����ȷ����(b��10-16)/a ��
(5)��Һ2�к���VO-3�����Ȼ�立�Ӧ�����ܽ��С��NH4VO3�����ӷ���ʽΪVO-3+NH4+=NH4VO3�����÷�Ӧ�ܷ�������ΪNH4VO3���ܣ���ȷ�𰸣�VO-3+NH4+=NH4VO3����NH4VO3���ܡ�


 ȫ�ŵ�����Ԫ�ƻ�ϵ�д�
ȫ�ŵ�����Ԫ�ƻ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����t��Cʱ��AgBr��ˮ�еij����ܽ�ƽ��������ͼ��ʾ����֪t��CʱAgCl��Ksp=4��10��10 �� ����˵������ȷ���ǣ������� 
A.ͼ��a���Ӧ����AgBr�IJ�������Һ
B.��t��Cʱ��AgBr��KspΪ 4.9��10��13
C.��AgBr������Һ�м���NaBr���壬��ʹ��Һ��c�㵽b��
D.��t��Cʱ��AgCl��s��+Br����aq��AgBr��s��+Cl����aq����ƽ�ⳣ��K��816
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ժ������ʵ��о����������ż�Ϊ��Ҫ�����壮
��1��N2��O2��H2�֮����Է������Ϸ�Ӧ����֪��Ӧ���Ȼ�ѧ����ʽ���£� N2��g��+O2��g��=2NO��g����H=+180kJmol��1��
2H2��g��+O2��g��=2H2O��g����H=��483kJmol��1��
N2��g��+3H2��g��=2NH3��g����H=��93kJmol��1 ��
�Ĵ�������Ӧ���Ȼ�ѧ����ʽΪ ��
��2������β��������һ����Ӧԭ��Ϊ��2NO��g��+2CO��g��N2��g��+2CO2��g����H��0�� һ���¶��£���2.8mol NO��2.4mol COͨ��̶��ݻ�Ϊ2L���ܱ������У���Ӧ�����в������ʵ����ʵ����仯��ͼ1��ʾ��
��NO��ƽ��ת����Ϊ �� 0��20minƽ����Ӧ����v��NO��Ϊmol/��Lmin�������¶��µĻ�ѧƽ�ⳣ����ֵ�� �� 25minʱ�������ַ�Ӧ�¶Ȳ��䣬���������г���CO��N2��0.8mol����ѧƽ�⽫ �ƶ�������������ҡ���������
�����п�˵���÷�Ӧ�Ѿ��ﵽƽ����� ��
a�� v���ɣ�CO2��=v���ģ�CO��
b�����������ܶȲ��ٸı�
c����������ƽ����Է����������ٸı�
d����λʱ��������2n mol CO2��ͬʱ����n mol N��N
e��NO��CO��N2��CO2��Ũ�����
�۷�Ӧ�ﵽƽ��ı�ijһ����������ͼ2���ߢ�������ȷ���� 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������е������������ǣ� ��
A.ʯī��
B.����������
C.����
D.������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڻ�ѧ��Ӧ�У�ֻ�м�����������ƽ�������ߵö�ķ�Ӧ����ӷ� ����ײʱ�ſ��ܷ�����ѧ��Ӧ����Щ���ӱ���Ϊ����ӡ�ʹ��ͨ���ӱ�ɻ���������ṩ������ȵ������л�ܣ��䵥λͨ���� kJ/mol ��ʾ��������۲���ͼ��Ȼ�� �ش����⡣

��1��ͼ����ʾ��Ӧ��_____(����ȡ����ȡ�)��Ӧ��
��2����֪�� 1mol H��H ����1mol I��I��1mol H��I ���ֱ���Ҫ���յ�����Ϊ 436kJ��151kJ��299kJ������ 1mol ������ 1mol �ⷴӦ���� HI ��_____(��ų������� �ա�)______kJ ���������ڻ�ѧ��Ӧ�����У��ǽ�_____ת��Ϊ_________��
��3�����з�Ӧ�У����ڷ��ȷ�Ӧ����_____���������ȷ�Ӧ����_____��
������ȼ�� ��ըҩ��ը ������кͷ�Ӧ �ܶ�����̼ͨ�����ȵ�̼
��ʳ�������������� ��Ba(OH)2��8H2O �� NH4Cl ��Ӧ ��������ϡ���ᷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ӷ���ʽCO32��+2H+��CO2��+H2O��ʾ���ǣ� ��
A.Na2CO3+2HCl��2NaCl+CO2��+H2O
B.NaHCO3+HCl��NaCl+CO2��+H2O
C.K2CO3+H2SO4��K2SO4+CO2��+H2O
D.K2CO3+2HNO3��2KNO3+CO2��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��װ�ý�����Ӧʵ��ܴﵽʵ��Ŀ�ĵ���
ѡ�� | A | B | C | D |
ʵ��װ�� |
|
|
|
|
ʵ��Ŀ�� | ��ɡ���Ȫ��ʵ�� | �ⶨ�к��� | ��ȡ���ռ����﴿����NH3 | ��ȡNO |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֦������������о�����ṹ��ʽ��ͼ�����й��ڷ�֦���������ȷ���ǣ������� 
A.�����к���2�ֹ�����
B.�����Ҵ������ᷴӦ���ҷ�Ӧ������ͬ
C.1mol��֦��������3molNaOH�����кͷ�Ӧ
D.��ʹ������Ȼ�̼��Һ�����Ը��������Һ��ɫ����ԭ����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������A��B��C��D��E��G����ǰ����������Ԫ�أ���֪A��B��C��D��E����Ԫ����Ԫ�����ڱ��е�λ����ͼ��ʾ��

(1)���ǽ���Ԫ��B�ĺ˵����Ϊx����A��B��C��D��E����Ԫ�صĺ˵����֮��Ϊ_________��
(2)��A��B��C��D����Ԫ�صĺ���������֮��Ϊ56��lmolG�ĵ������������ᷴӦ���ܲ���22. 4LH2���ڱ�״���£���G����������D�������Ӻ�����Ӳ�ṹ��ͬ��
��д������Ԫ�����ƣ�A_________��B________��
��D�ļ����ӽṹʾ��ͼΪ_________��
���⻯��ķе㣺D_________B�����⻯��ˮ��Һ�����ԣ�B_________C���>����<����=������
�ܼ�ΪG��C��Ԫ����ɵĻ�����õ���ʽ��ʾ���γɹ���_________��
(3)����˵����ȷ����_________������ţ�
A������Ǽ����Ļ�ѧ�����κ������ж����ڻ�ѧ��
B�����ۻ������гɼ�ԭ�Ӿ�����ϡ��������ȶ��ṹ
C.���ַǽ���Ԫ���γɵĻ�������ܺ������Ӽ�
D����ѧ�����ѣ�һ��������ѧ�仯
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com