
【题目】在1200℃时,天然气脱硫工艺中会发生下列反应:
H2S(g)+3/2 O2(g)═SO2(g)+H2O(g) △H1
2H2S(g)+SO2(g)═3/2 S2(g)+2H2O(g) △H2
H2S(g)+1/2 O2(g)═S(g)+H2O(g) △H3
2S(g)═S2(g) △H4
则△H4的正确表达式为( )
A.△H4=3/2(△H1-△H2-3△H3)B.△H4=2/3 (3△H3-△H1-△H2)
C.△H4=3/2(△H1+△H2-3△H3)D.△H4=2/3 (△H1+△H2-3△H3)
科目:高中化学 来源: 题型:
【题目】KClO3和KHSO3能发生反应:ClO3-+HSO3-→SO42-+ Cl-+ H+(未配平)。已知该反应的速率随c(H+)的增大而加快。下图为用ClO3-在单位时间内物质的量浓度变化表示的该反应υ-t图。下列说法正确的
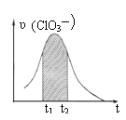
A. 反应开始时速率增大可能是c(H+)所致
B. 纵坐标为υ(Cl-)的υ-t曲线与图中曲线不能完全重合
C. 后期速率υ下降的主要原因是反应向逆反应方向进行
D. 图中阴影“面积”可以表示t1-t2时间内c(SO42-)增加量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A.硫酸铜与Ba(OH)2溶液反应:Cu2++2OH-=Cu(OH)2↓
B.腐蚀法制作印刷线路板:2Fe3++Cu=2Fe2++Cu2+
C.向AlCl3溶液中加入足量的氨水:Al3++4OH-=AlO2-+2H2O
D.将Na投入到CuSO4溶液中:2Na + Cu2+ =2Na+ + Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲苯(![]() )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(![]() )、苯甲酸(
)、苯甲酸(![]() )等产品。表列出了有关物质的部分物理性质,请回答:
)等产品。表列出了有关物质的部分物理性质,请回答:
名称 | 性状 | 熔点(℃) | 沸点(℃) | 相对密度 (ρ水=1g/cm3) | 溶解性 | |
水 | 乙醇 | |||||
甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
注:甲苯、苯甲醛、苯甲酸三者互溶。
实验室可用如图装置模拟制备苯甲醛。实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入15mL冰醋酸(作为溶剂)和2mL甲苯,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时。
 (1)装置a的名称是______________。
(1)装置a的名称是______________。
(2)三颈瓶中发生反应的化学方程式为_______________________________________。
(3)经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是_____________________________________________。
(4)反应完毕后,反应混合液经过自然冷却至室温时,还应经过_____、_____(填操作名称)等操作,才能得到苯甲醛粗产品。
(5)实验中加入过量过氧化氢且反应时间较长,会使苯甲醛产品中产生较多的苯甲酸。
①若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的操作步骤是_______(按步骤顺序填字母)。
a.对混合液进行分液 b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2 d.加入适量碳酸氢钠溶液混合振荡
②若对实验①中获得的苯甲酸产品进行纯度测定,可称取2.500g产品,溶于200mL乙醇配成溶液,量取所得的乙醇溶液20.00mL于锥形瓶,滴加2~3滴酚酞指示剂,然后用预先配好的0.1000mol/L KOH标准液滴定,到达滴定终点时消耗KOH溶液18.00mL。产品中苯甲酸的质量分数为_____。(苯甲酸相对分子质量:122.0)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种双室微生物燃料电池污水净化系统原理如图所示,图中酸性污水中含有的有机物用C6H12O6表示。下列有关该电池的说法不正确的是( )
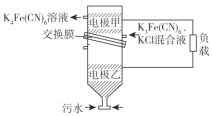
A.正极的电极反应为Fe(CN)63-+ e- =Fe(CN)64-
B.电池的总反应为C6H12O6 + 24Fe(CN)63-+6H2O=6CO2↑+Fe(CN)64-+24H+
C.该“交换膜”可选用“质子交换膜”
D.若将“K4Fe(CN)6溶液”改为“O2”,当有22.4L O2参与反应时,理论上转移4mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)含碳物质的价值型转化,有利于“减碳”和可持续性发展,有着重要的研究价值。请回答下列问题:
(1)已知CO分子中化学键为C≡O。相关的化学键键能数据如下:
化学键 | H—O | C≡O | C=O | H—H |
E/(kJ·mol1) | 463 | 1075 | 803 | 436 |
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=___________kJ·mol1。下列有利于提高CO平衡转化率的措施有_______________(填标号)。
CO2(g)+H2(g) ΔH=___________kJ·mol1。下列有利于提高CO平衡转化率的措施有_______________(填标号)。
a.增大压强 b.降低温度
c.提高原料气中H2O的比例 d.使用高效催化剂
(2)用惰性电极电解KHCO3溶液,可将空气中的CO2转化为甲酸根(HCOO),然后进一步可以制得重要有机化工原料甲酸。CO2发生反应的电极反应式为________________,若电解过程中转移1 mol电子,阳极生成气体的体积(标准状况)为_________L。
(3)乙苯催化脱氢制取苯乙烯的反应为:![]() (g)+CO2(g)
(g)+CO2(g)![]()
![]() (g)+CO(g)+H2O(g),其反应历程如下:
(g)+CO(g)+H2O(g),其反应历程如下:
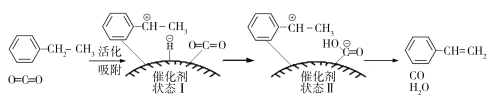
①由原料到状态Ⅰ____________能量(填“放出”或“吸收”)。
②一定温度下,向恒容密闭容器中充入2 mol乙苯和2 mol CO2,起始压强为p0,平衡时容器内气体总物质的量为5 mol,乙苯的转化率为_______,用平衡分压代替平衡浓度表示的化学平衡常数Kp=_______。[气体分压(p分)=气体总压(p总)×气体体积分数]
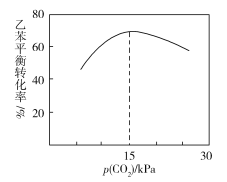
③乙苯平衡转化率与p(CO2)的关系如下图所示,请解释乙苯平衡转化率随着p(CO2)变化而变化的原因________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图装置制备并收集干燥纯净的Cl2。
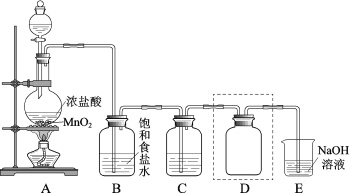
(1)装置A中反应的化学方程式是___。
(2)装置B的作用是__。
(3)装置C中盛放的物质是__。
(4)装置D用于收集Cl2,请将图中装置D的导气管补充完整___。
(5)装置E用于吸收尾气,E中反应的离子方程式是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术发展史上的一项重大突破,研究表明液氨是一种良好的储氢物质。
(1)N2(g)+3H2(g)2NH3(g) △H<0,研究表明金属催化剂可加速氨气的合成。下表为某温度下等质量的不同金属分别催化合成氨气时,氢气的初始速率(mmol min-1)。
催化剂 | Ru | Rh | Ni | Pt | Pd | Fe |
初始速率 | 7.9 | 4.0 | 3.0 | 2.2 | 1.8 | 0.5 |
①不同催化剂存在下,合成氨气反应的活化能最大的是_______ (填写催化剂的化学式)。
②某研究小组进一步探究催化剂对合成氨气的影响。将N2和H2以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NH3含量,如下图,从而确定温度对催化剂的影响。a点___ (填“是”或“不是”)对应温度下氨气平衡时的百分含量,说明其理由___。

(2)氨气的分解反应2NH3N2+3H2 △H<0,,在实际生产中往刚性容器中同时通入氨气和水蒸气,测得容器总压和氨气转化率随时间变化结果如图所示。
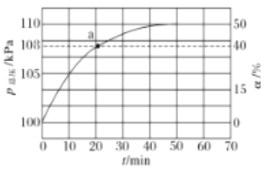
①平衡时,p(H2O)= ___kPa,平衡常数Kp=_____KPa2(Kp为以分压表示的平衡常数)。
②反应速率v=v正-v逆=K正p2(NH3)-K逆p(N2)p3(H2),k正、k逆分别为正、逆反应速率常数。计算a处的![]() =__。
=__。
(3)液氨中,2NH3(l)NH2-+NH4+,用Pt电极对液氨进行电解也可产生H2和N2。阴极的电极反应______。
(4)在室温下用氨水吸收SO2。将含SO2的烟气通入该氨水中,当溶液显中性时,溶液中的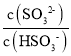 =____。(已知25℃,Kb(NH3H2O)=1.810-5;Ka1(H2SO3)=.310-2,Ka2(H2SO3)=6.210-8)
=____。(已知25℃,Kb(NH3H2O)=1.810-5;Ka1(H2SO3)=.310-2,Ka2(H2SO3)=6.210-8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源,氢气的制取、储存一直是氢能源利用领域的研究热点。
(1)工业上制取![]() 有多种方法,如:
有多种方法,如:
①![]()
②![]()
③![]()
甲烷和水蒸气催化重整制高纯氢时,初始反应的生成物为![]() 和
和![]() ,其物质的量之比为4:1,则该反应的热化学方程式为________。
,其物质的量之比为4:1,则该反应的热化学方程式为________。
(2)镧镍合金是一种良好的储氢材料,向体积恒定的密闭容器中充入氢气发生如下反应:![]() 。
。![]() 的平衡转化率与其初始充入物质的量
的平衡转化率与其初始充入物质的量![]() 、反应温度
、反应温度![]() 的关系如左图所示;一定温度下,容器内的压强
的关系如左图所示;一定温度下,容器内的压强![]() 随时间
随时间![]() 的变化关系如右图所示。
的变化关系如右图所示。
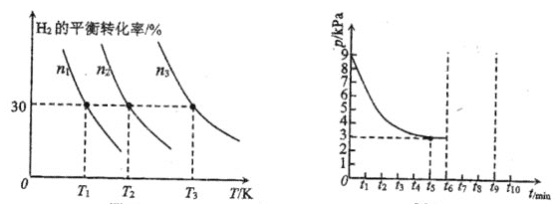
①左图中![]() 初始充入量由大到小的是________。
初始充入量由大到小的是________。
②该反应平衡常数的大小关系为![]() ________
________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() ,理由是________。
,理由是________。
③若保持温度不变,在![]() 时刻将容器的容积压缩至原来的一半,并在
时刻将容器的容积压缩至原来的一半,并在![]() 时刻达到平衡。请在右图中画出相应的变化曲线______。
时刻达到平衡。请在右图中画出相应的变化曲线______。
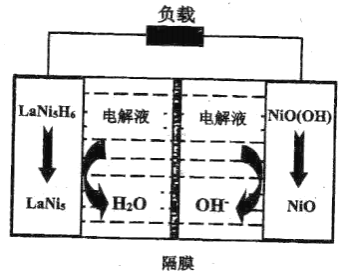
④某二次镍氢电池放电时的工作原理如图所示,其中隔膜为________离子交换膜![]() 填“阴”或“阳”
填“阴”或“阳”![]() ,负极的电极反应式为________。
,负极的电极反应式为________。
(3)储氢还可以借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:
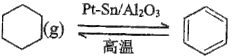
![]() 。在某温度下,向容积为2L的恒容容器中加入
。在某温度下,向容积为2L的恒容容器中加入![]() 环己烷,平衡时体系中压强为
环己烷,平衡时体系中压强为![]() ,苯的物质的量为
,苯的物质的量为![]() ,则平衡常数
,则平衡常数![]() ________
________![]() 用含a、b、p的代数式表示;用平衡分压代替平衡浓度计算,分压
用含a、b、p的代数式表示;用平衡分压代替平衡浓度计算,分压![]() 总压
总压![]() 物质的量分数
物质的量分数![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com