
����Ŀ��KClO3��KHSO3�ܷ�����Ӧ��ClO3��+HSO3����SO42��+ Cl��+ H+(δ��ƽ)����֪�÷�Ӧ��������c(H+)��������ӿ졣��ͼΪ��ClO3���ڵ�λʱ�������ʵ���Ũ�ȱ仯��ʾ�ĸ÷�Ӧ��-tͼ������˵����ȷ��
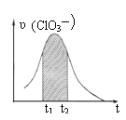
A. ��Ӧ��ʼʱ�������������c(H+)����
B. ������Ϊ��(Cl��)����-t������ͼ�����߲�����ȫ�غ�
C. �����������½�����Ҫԭ���Ƿ�Ӧ���淴Ӧ�������
D. ͼ����Ӱ����������Ա�ʾt1-t2ʱ����c(SO42-)������
���𰸡�A
��������
1molClO3-�μ�������ԭ��Ӧ�õ�6mol���ӣ�1mol������������Ӳμ�������ԭ��Ӧʧȥ2mol���ӣ����Ե�ʧ���ӵ���С��������6����ClO3-�ļ�������1��������������ӵļ�������3����ԭ�Ӹ����غ�ɵ÷�Ӧ����ʽΪClO3-+3HSO3-=3SO42-+Cl-+3H+��
A��������Ϣ��֪��Ӧ��������c��H+����������ӿ죬�ɷ���ʽ��֪����Ӧ��ʼʱ���ŷ�Ӧ�Ľ��У�c��H+����������Ӧ�����ʼӿ죬��A��ȷ��
B���ѧ��Ӧ����֮�ȵ��ڻ�ѧ������֮�ȣ��ɷ���ʽ��֪����ClO3-��������Cl-��=1��1����������Ϊ����Cl-������-t������ͼ�������غϣ���B����
C����ŷ�Ӧ�Ľ��У���Ӧ���Ũ�ȼ��٣���Ӧ���ʼ�С�����Ժ��ڷ�Ӧ�����½�����Ҫԭ���Ƿ�Ӧ��Ũ�ȼ�С����C����
D�ͼ����Ӱ����������Ա�ʾt1-t2ʱ����c(ClO3-)���������ɷ���ʽ��֪��SO42-�Ļ�ѧ��������ClO3-��3������t1-t2ʱ����c(SO42-)������Ӧ��c(ClO3-)��������3������D����
��ѡA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪25�� Cʱ����Ԫ��H2X�ĵ���ƽ�ⳣ��K1=5.0��10-2��K2=5.4��10-5�����¶�����AgNO3��Һ�ֱ�ζ�Ũ�Ⱦ�Ϊ0.01mol��L-1��KY��K2X��Һ�����õij�����AgY��Ag2X���ܽ�ƽ��ͼ����ͼ��ʾ������������ȷ����
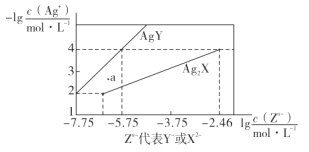
A.25��Cʱ��KHX����ҺpH>7
B.��ӦAg2X+2Y- 2AgY+ X2-��ƽ�ⳣ��Ϊ103.29
C.a��ȿ��Ա�ʾAgY�IJ�������ҺҲ���Ա�ʾAg2X�Ĺ�������Һ
D.��c(Y-)=c(X2-)=0.01 mol��L-1�Ļ��Һ�е���AgNO3��Һʱ��������AgY����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȡ���̿�ʯ����Ҫ�ɷ�Ϊ![]() ��
��![]() ������Ũ���ᷢ�����·�Ӧ�����ʲ����뷴Ӧ��
������Ũ���ᷢ�����·�Ӧ�����ʲ����뷴Ӧ��![]() ���Ƶ�
���Ƶ�![]() ����״�����������й�˵���в���ȷ���ǣ� ��
����״�����������й�˵���в���ȷ���ǣ� ��
A. �������̿�ʯ��![]() ����������Ϊ
����������Ϊ![]()
B. ��������![]() �����ʵ���Ϊ
�����ʵ���Ϊ![]()
C. �μӷ�Ӧ��![]() ������Ϊ
������Ϊ![]()
D. ����ԭ��![]() �����ʵ���Ϊ
�����ʵ���Ϊ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ��Ϊ̽�����������̼�ķ�Ӧ��������ͼװ�ý���ʵ�顣
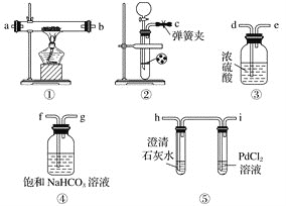
��֪PdCl2�ܱ�һ����̼��ԭ�õ���ɫ��Pd����ش��������⣺
��1���뽫��ͼ��װ������������c��f��______��______��______��______��______��______��
��2������ϡ������̼��Ʒ�Ӧ�Ʊ�������̼���ڼ�ϡ����ʱ������̼�����ϡ����ܽӴ�����ϡ�����ֲ����ˣ�Ϊʹ��Ӧ��˳�����У�����©���м�����Լ���______������ĸ����
A����������Һ B�����Ȼ�̼ C���� D��ϡ����
��3�����װ�������Բ�װ��ҩƷ��ȼ�ƾ���֮ǰӦ���еIJ����Ǵ��ɼУ��ö�����̼��������װ�ã����۲쵽________________ʱ���ٵ�ȼ�ƾ��ơ��˲�������Ŀ����________________________________��
��4����Ӧ�����ж�����̼���������練Ӧ����������������������ֱ�д��������������������̼��Ӧ�Ļ�ѧ����ʽ��
��.װ�â�PdCl2��Һ�й۲쵽�к�ɫ������װ�â��й���ɷ�ֻ��һ�֣���������м���ϡ���������ʹ����ʯ��ˮ����ǵ����壺 ___________________________��
��.װ�â����Ƶ�����Ϊ0.46 g����ַ�Ӧ��װ�â��еĹ�����뵽����ϡ�����в���224 mL(��״��)������̼���壬����Һ�л��й��������_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)����β���е� NO��CO���ڴ�����������������Ⱦ���������ȥ�����ܱ������г���10 mol CO��8 mol NO������Ӧ�����ƽ��ʱNO������������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��
����֪�÷�Ӧ�ڽϵ��¶������Է����У���Ӧ 2NO(g)+2CO(g)![]() N2(g)+2CO2 (g)����H______0������>�� ��=������<������
N2(g)+2CO2 (g)����H______0������>�� ��=������<������
�ڸ÷�Ӧ�ﵽƽ���Ϊͬʱ��߷�Ӧ���ʺ�CO��ת���ʣ��ɲ�ȡ�Ĵ�ʩ��______ (����ĸ���)
a.���ø�Ч���� b����С��������� c������ NO ��Ũ�� d�������¶�
(2)�����������£����ʹ���M�ܴ�NH3��NOx��Ӧ����N2����һ��������O2��NH3 ��NOx�Ļ����������ͨ��װ�д���M�ķ�Ӧ���з�Ӧ����Ӧ��ͬʱ�䣬NOx��ȥ�����淴Ӧ�¶ȵı仯������ͼ��ʾ��
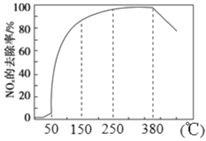
������50 �桫150 �淶Χ�����¶����ߣ�NOx ��ȥ����Ѹ��������ԭ����_______
(3)NH3����ԭ�������\����ĿǰӦ����㷺�������ѵ�������4NH3(g)+6NO(g) ![]() 5N2(g)+6H2O(g) ��H<0���ܱ������У�����ͬʱ���ڣ��ڴ��� A�������ѵ������¶ȱ仯��ͼ��ʾ��
5N2(g)+6H2O(g) ��H<0���ܱ������У�����ͬʱ���ڣ��ڴ��� A�������ѵ������¶ȱ仯��ͼ��ʾ��
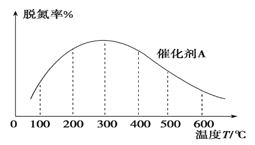
�ָ��ô����������Ĵ���B����ʵ�飬������ͼ�л����ڴ��� B�����µ��ѵ������¶ȱ仯������_________���������¶ȶԴ������Ե�Ӱ�죩��
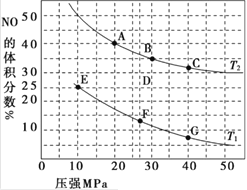
(4)ij�о�С�����÷�Ӧ��C(s)+2NO(g)![]() N2(g)+CO2(g) �� H= -34.0 kJ/mol���û���̿��NO������������֪���ܱ������м���������C��һ������NO���壬���ֺ�ѹ��� NO��ת�������¶ȵı仯��ͼ��ʾ��
N2(g)+CO2(g) �� H= -34.0 kJ/mol���û���̿��NO������������֪���ܱ������м���������C��һ������NO���壬���ֺ�ѹ��� NO��ת�������¶ȵı仯��ͼ��ʾ��
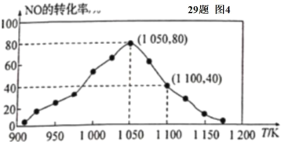
����ͼ��֪���� 1050 K ǰ����Ӧ�� NO��ת�������¶����{��������ԭ��Ϊ____________�� �� 1100 K ʱ��N2���������Ϊ____________��
����ij���ʵ�ƽ���ѹ���������ʵ���Ũ��Ҳ���Ա�ʾ��ѧƽ�ⳣ��(���� Kp )���� 1050 K��1.1��106 Pa ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ�� Kp=____________����֪�������ѹ(P��) =������ѹ(Pa)�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ᷨ�Ѱ��������ŷŵĺ��̷�ˮ(��Ҫ��������ΪMn2����Fe2����Al3��������������Ca2����Mg2����Cu2����Ni2��������)Ϊԭ�ϣ�����MnCO3�Ĺ����������£�
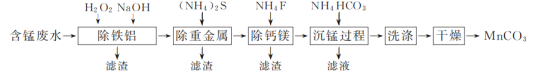
��֪��25 ��ʱ��Ksp(CaF2)��1.5��10��10��Ksp(MgF2)��7.5��10��11��
(1)�����к��̷�ˮ����ǰ����Ԥ�������õ���Ҫ����Mn2����ĸҺ��
�ٳ�����ʱ���ڽ����������ȼ���H2O2��Һ���ټ���NaOH��Һ����pH������H2O2��Һʱ������Ӧ�����ӷ���ʽΪ__________________________________________��
�ڳ���þ�����У���Ca2����Mg2��������ȫʱ����Һ��![]() ��________��
��________��
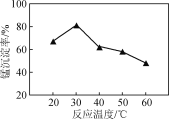
(2) ���̹�����pHΪ7.0�����³�ֽ��У���Ӧ�¶ȶ��̳����ʵ�Ӱ���ϵ��ͼ��ʾ��
�ٳ��̹��̷�����Ӧ�����ӷ���ʽΪ____________���ù����м����ʵ�������NH4HCO3��ԭ����________��
�ڵ��¶ȳ���30 �������̷�Ӧ���̳��������¶����߶��½���ԭ����______________________________��
(3) ���̺���˵õ�MnCO3�ֲ�Ʒ��������ȥ����ˮ����ˮ�Ҵ���ϴ��2��3�Σ��ٵ��¸���õ�������MnCO3������ˮ�Ҵ�ϴ�ӵ�Ŀ����____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪһ�������²��ö���Ե缫�Ĵ����س��װ�ã����������л������֪����װ�õĵ���Ч��![]() ��100%������˵������ȷ����
��100%������˵������ȷ����
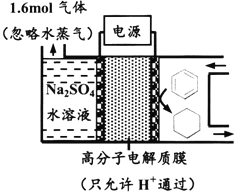
A. ���ö�缫�����˽Ӵ�������ɽ��͵��������ʧ
B. ������ͨ��C-H���Ķ���ʵ����Ĵ���
C. ����Ŀ�����ĵ缫��ӦʽΪC6H6+6e-+6H+===C6H12
D. ��![]() =75%����μӷ�Ӧ�ı�Ϊ0.8mol
=75%����μӷ�Ӧ�ı�Ϊ0.8mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵĻ�ѧ���������ȷ���ǣ�������
A. ��ϩ�Ľṹ��ʽ��CH2CH2 B. �ǻ��ĵ���ʽ��![]()
C. �״������ģ�ͣ�![]() D. �����ʵ��ʽ��CH3COOH
D. �����ʵ��ʽ��CH3COOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1200��ʱ����Ȼ���������лᷢ�����з�Ӧ��
H2S��g��+3/2 O2��g���TSO2��g��+H2O��g�� ��H1
2H2S��g��+SO2��g���T3/2 S2��g��+2H2O��g�� ��H2
H2S��g��+1/2 O2��g���TS��g��+H2O��g�� ��H3
2S��g���TS2��g�� ��H4
���H4����ȷ����ʽΪ�� ��
A.��H4=3/2����H1-��H2-3��H3��B.��H4=2/3 ��3��H3-��H1-��H2��
C.��H4=3/2����H1+��H2-3��H3��D.��H4=2/3 ����H1+��H2-3��H3��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com