
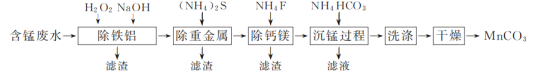
【题目】以硫酸法钛白粉生产中排放的含锰废水(主要金属离子为Mn2+、Fe2+、Al3+,还含有少量Ca2+、Mg2+、Cu2+和Ni2+等离子)为原料,生产MnCO3的工艺流程如下:
已知:25 ℃时,Ksp(CaF2)=1.5×10-10、Ksp(MgF2)=7.5×10-11。
(1)流程中含锰废水经过前三步预处理,得到主要含有Mn2+的母液。
①除铁铝时,在搅拌条件下先加入H2O2溶液,再加入NaOH溶液调节pH。加入H2O2溶液时发生反应的离子方程式为__________________________________________。
②除钙镁步骤中,当Ca2+、Mg2+沉淀完全时,溶液中![]() =________。
=________。
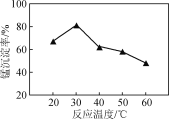
(2) 沉锰过程在pH为7.0条件下充分进行,反应温度对锰沉淀率的影响关系如图所示。
①沉锰过程发生反应的离子方程式为____________。该过程中加入适当过量的NH4HCO3的原因是________。
②当温度超过30 ℃,沉锰反应的锰沉淀率随温度升高而下降的原因是______________________________。
(3) 沉锰后过滤得到MnCO3粗产品,依次用去离子水和无水乙醇各洗涤2~3次,再低温干燥,得到纯净的MnCO3。用无水乙醇洗涤的目的是____________________________。
【答案】2Fe2++H2O2+2H+=2Fe3++2H2O 2 Mn2++2HCO3-=MnCO3↓+H2O+CO2↑ 提高Mn2+的沉淀率 温度升高,NH4HCO3受热分解(或Mn2+水解) 有利于低温条件下快速干燥
【解析】
含锰废水经过除铁铝时,铁亚铁离子被氧化成铁离子,铁离子和铝离子转化为氢氧化物沉淀,经过除重金属时,铜离子和镍离子转化为硫化铜和硫化镍沉淀,经过除钙镁时,钙离子和镁离子转化为氟化钙和氟化镁沉淀,溶液中的锰离子在沉锰时转化为碳酸锰沉淀,后经洗涤干燥得到纯净的碳酸锰。
(1)①加入H2O2溶液是将亚铁离子氧化成铁离子,便于转化成沉淀除去,其反应的离子反应方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
②钙离子和镁离子转化为氟化钙和氟化镁沉淀,则溶液中![]() ,故答案为:2;
,故答案为:2;
(2)①沉锰过程中加入过量的碳酸氢铵,提供碳酸根将锰离子尽可能多的转化为碳酸锰沉淀,提高Mn2+的沉淀率,其反应的离子反应方程式为Mn2++2HCO3-=MnCO3↓+H2O+CO2↑,故答案为:Mn2++2HCO3-=MnCO3↓+H2O+CO2↑;提高Mn2+的沉淀率;
②铵盐受热易分解,当温度过高时,碳酸氢铵容易分解,而温度升高时,锰离子水解程度也会增大,所以沉锰反应的锰沉淀率随温度升高而下降,故答案为:温度升高,NH4HCO3受热分解(或Mn2+水解);
(3)沉锰后过滤得到MnCO3粗产品,用去离子水洗去表面的杂质离子,因为碳酸锰高温时容易分解,所以干燥时用易挥发的乙醇低温下除去水分,使碳酸锰快速干燥,得到纯净的碳酸锰,故答案为:有利于低温条件下快速干燥。


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】(1)能判断CO2(g)+H2(g)![]() CO(g)+H2O(g)达到化学平衡状态的依据是____(填字母)。
CO(g)+H2O(g)达到化学平衡状态的依据是____(填字母)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO)=c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。

该条件下反应的平衡常数为_____;若铁粉足量,CO2的起始浓度为2.0mol·L-1,则平衡时CO的浓度为____mol·L-1。
②下列措施中能使平衡时![]() 增大的是___(填字母)。
增大的是___(填字母)。
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下氨气能与 CaCl2 固体结合生成 CaCl2·8NH3。下列说法不正确的是
A.CaCl2·6NH3(s)+ 2NH3(g) ![]() CaCl2·8NH3(s) ΔH < 0
CaCl2·8NH3(s) ΔH < 0
B.实验室可用氯化铵固体和熟石灰共热来制备氨气,说明相对高温不利于 CaCl2 与氨气的化合
C.常温下,在密闭容器中缩体加压能增加体系中活化分子百分数,有利于氨气的吸收
D.CaCl2·6NH3(s) CaCl2·c4NH3(s)+ 2NH3(g),He 气流可促进反应进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CO和H2合成CH3OH的化学方程式为CO(g)+2H2(g) ![]() CH3OH(g) AH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示,下列说法正确的是( )
CH3OH(g) AH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示,下列说法正确的是( )

A. 温度:T1>T2>T3
B. 正反应速率:v(a)>v(c), v(b)>v(d)
C. 平衡常数:K(a)>K(c),K(b)=K(d)
D. 平均摩尔质量:M(a)<M(c),M(b)<M(d)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KClO3和KHSO3能发生反应:ClO3-+HSO3-→SO42-+ Cl-+ H+(未配平)。已知该反应的速率随c(H+)的增大而加快。下图为用ClO3-在单位时间内物质的量浓度变化表示的该反应υ-t图。下列说法正确的
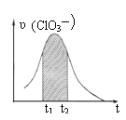
A. 反应开始时速率增大可能是c(H+)所致
B. 纵坐标为υ(Cl-)的υ-t曲线与图中曲线不能完全重合
C. 后期速率υ下降的主要原因是反应向逆反应方向进行
D. 图中阴影“面积”可以表示t1-t2时间内c(SO42-)增加量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是( )
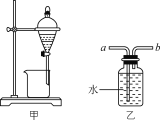
A.用装置甲分液时,两层液体应依次从下口放出
B.用装置乙除去NO中混有的少量NO2时,应将混合气体从a管通入
C.中和滴定时,锥形瓶应先用待测液润洗2~3次
D.配制溶液时加水超过容量瓶的刻度线,应立即用胶头滴管吸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项中所示的物质间转化均能实现的是( )
A.Al(s)![]() Al(OH)3(s)
Al(OH)3(s)![]() Al2O3(s)
Al2O3(s)
B.FeS2(s)![]() SO2(g)
SO2(g)![]() BaSO3(s)
BaSO3(s)
C.Cl2(g)![]() NaClO(aq)
NaClO(aq)![]() HClO(aq)
HClO(aq)
D.Fe(s)![]() Fe2O3(s)
Fe2O3(s)![]() Fe2(SO4)3(aq)
Fe2(SO4)3(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体:
①D的化学式是________;
②在工业生产中,B气体的大量排放被雨水吸收后形成了________而污染了环境。
(2)若A在常温下为气体,C是红棕色的气体:
①A、C的化学式分别是:A________;C________。
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式_______________________________________________。该反应________(填“属于”或“不属于”)氧化还原反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)含碳物质的价值型转化,有利于“减碳”和可持续性发展,有着重要的研究价值。请回答下列问题:
(1)已知CO分子中化学键为C≡O。相关的化学键键能数据如下:
化学键 | H—O | C≡O | C=O | H—H |
E/(kJ·mol1) | 463 | 1075 | 803 | 436 |
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=___________kJ·mol1。下列有利于提高CO平衡转化率的措施有_______________(填标号)。
CO2(g)+H2(g) ΔH=___________kJ·mol1。下列有利于提高CO平衡转化率的措施有_______________(填标号)。
a.增大压强 b.降低温度
c.提高原料气中H2O的比例 d.使用高效催化剂
(2)用惰性电极电解KHCO3溶液,可将空气中的CO2转化为甲酸根(HCOO),然后进一步可以制得重要有机化工原料甲酸。CO2发生反应的电极反应式为________________,若电解过程中转移1 mol电子,阳极生成气体的体积(标准状况)为_________L。
(3)乙苯催化脱氢制取苯乙烯的反应为:![]() (g)+CO2(g)
(g)+CO2(g)![]()
![]() (g)+CO(g)+H2O(g),其反应历程如下:
(g)+CO(g)+H2O(g),其反应历程如下:
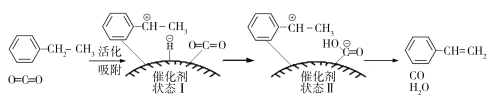
①由原料到状态Ⅰ____________能量(填“放出”或“吸收”)。
②一定温度下,向恒容密闭容器中充入2 mol乙苯和2 mol CO2,起始压强为p0,平衡时容器内气体总物质的量为5 mol,乙苯的转化率为_______,用平衡分压代替平衡浓度表示的化学平衡常数Kp=_______。[气体分压(p分)=气体总压(p总)×气体体积分数]
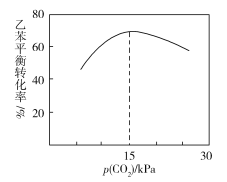
③乙苯平衡转化率与p(CO2)的关系如下图所示,请解释乙苯平衡转化率随着p(CO2)变化而变化的原因________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com