
����Ŀ���ǽ�������A����ͼ��ʾ�Ĺ���ת��Ϊ������D����֪DΪǿ�ᣬ��ش��������⡣
![]()
![]()
![]()
![]()
![]()
![]()
![]()
��1����A�ڳ�����Ϊ���壬B����ʹƷ����Һ��ɫ���д̼�����ζ����ɫ����:
��D�Ļ�ѧʽ��________��
���ڹ�ҵ�����У�B����Ĵ����ŷű���ˮ���պ��γ���________����Ⱦ�˻�����
��2����A�ڳ�����Ϊ���壬C�Ǻ���ɫ������:
��A��C�Ļ�ѧʽ�ֱ��ǣ�A________��C________��
��D��Ũ��Һ�ڳ����¿���ͭ��Ӧ������C���壬��д���÷�Ӧ�Ļ�ѧ����ʽ_______________________________________________���÷�Ӧ________(����������������������)������ԭ��Ӧ��
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��һ��װ��Ʒ����Ҫ�ɷ֣�������ͼת����ϵ���ش��������⡣
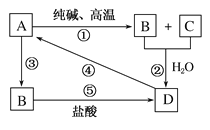
(1)A����;Ϊ________(��дһ��)��B��________��D��________��
(2)д����ѧ����ʽ��
��________________________________________��
��________________________________________��
(3)д�����ӷ���ʽ��
��___________________________________________��
��___________________________________________��
��___________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��AԪ�ص�һ�ֵ�����һ����Ҫ�İ뵼����ϣ���AԪ�ص�һ�ֻ�����C��������������ܵ��ִ�ͨѶ�����������ά��C���ռӦ���ɺ�AԪ�صĻ�����D��
(1)д��C���ᷢ����Ӧ�Ļ�ѧ����ʽ��________________��
(2)��C�봿���ϸ�������ʱҲ������ѧ��Ӧ����D��ͬʱ������B�����������E����ȫ����E��ȫ����D��������ˮ�л�Ϻ��ַ�����ѧ��Ӧ���ɺ�A�Ļ�����F��
�ٷֱ�д������D��F�Ļ�ѧ����ʽ��________________��________________��
��Ҫ��NaOH�����ۻ������������п�ѡ�õ���________(����ĸ)��
A����ͨ�������� B��ʯӢ�������� C������������ D��������
(3)100 g C��ʯ��ʯ�Ļ�����ַ�Ӧ�����ɵ������ڱ���µ����Ϊ11.2 L��100 g�������ʯ��ʯ������������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С��������ͼ��ʾװ�ü���Ũ������ľ̿��Ӧ�ĸ��ֲ��
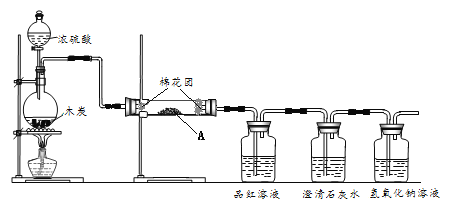
��ش�
��1��Ũ������ľ̿��Ӧ�Ļ�ѧ����ʽ��______��
��2���Լ�A��______��
��3��Ʒ����Һ��������______��
��4������ʯ��ˮ����ǣ��ܷ�һ��˵�����ɶ�����̼��������______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ����������ʯī������ʢ�б���NaCl��Һ��U���С����з�����ȷ���ǣ� ��

A. K1�պϣ������Ϸ����ķ�ӦΪ2H����2e����H2��
B. K1�պϣ�ʯī����Χ��ҺpH������
C. K2�պϣ��������ᱻ��ʴ��������������������������
D. K2�պϣ���·��ͨ��0.002NA������ʱ������������0.001mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����˳�����д�����ǣ� ��
A.�⻯���ȶ�����ǿ��HF��H2O��NH3B.���Լ�����HClO4��HBrO4��HIO4
C.��ԭ����ǿ��A1��Mg��NaD.�ǽ����Լ�����Cl��S��P
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������25 ��ʱ0.1 mol��L-1�İ�ˮ����ش��������⣺
��1������ˮ�м�����������粒��壬��ʱ��Һ��![]() ________������������������С����������������
________����������������������������������
��2������ˮ�м���ϡ���ᣬʹ��ǡ���кͣ�д����Ӧ�����ӷ���ʽ��__________��������Һ��pH________7������>������<�������������������ӷ���ʽ��ʾ��ԭ��__________;������Һ�и��������ʵ���Ũ���ɴ�С��˳����____________________��
��3������ˮ�м���ϡ��������Һ��pH��7����ʱc(NH![]() )��a moL.L-1����c(SO42-)Ϊ________��
)��a moL.L-1����c(SO42-)Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����������γ�˳���칹�����
A. 1��1-������ϩ B. ��ϩ C. 1��2-������ϩ D. 1-��ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������س���������ɱ����ˮ�ʾ������ȡ�ijС�������̿�(��Ҫ��MnO2,����������SiO2��Al2O3��Fe2O3������)ģ�ҵ�Ƹ�������������¡��Իش��������⡣
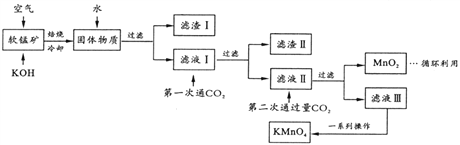
(1)��ƽ����ʱ��ѧ��Ӧ: ��MnO2+��_____+��O2![]() ��K2MnO4+��H2O����ҵ�����в��öԿ�����ѹ�ķ������MnO2�����ʣ�������ײ���۽�����ԭ��__________��
��K2MnO4+��H2O����ҵ�����в��öԿ�����ѹ�ķ������MnO2�����ʣ�������ײ���۽�����ԭ��__________��
(2)����II �ijɷ���_______(��ѧʽ);��һ��ͨCO2������ϡ��������ԭ����_________��
(3)�ڶ���ͨ�����CO2����MnO2�����ӷ���ʽΪ_________��
(4)����Һ������һϵ�в�����KMnO4��
����ͼ��֪,����Һ��õ�KMnO4�辭��_____��______��ϴ�ӵȲ�����

(5)��ҵ�ϰ���������������������MnO2a%�����̿�1�֣�������������KMnO4___�֡�
(6)���õ�ⷨ�ɵõ�������KMnO4���ö��Ե缫�����ҺII��
�ٵ���������ӦʽΪ____________��
���������������������,��������__________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com