
【题目】A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料——光导纤维,C与烧碱反应生成含A元素的化合物D。
(1)写出C与酸发生反应的化学方程式是________________。
(2)将C与纯碱混合高温熔融时也发生化学反应生成D,同时还生成B的最高价氧化物E;将全部的E与全部的D在足量的水中混合后,又发生化学反应生成含A的化合物F。
①分别写出生成D和F的化学方程式:________________,________________。
②要将NaOH高温熔化,下列坩埚中可选用的是________(填字母)。
A.普通玻璃坩埚 B.石英玻璃坩埚 C.氧化铝坩埚 D.铁坩埚
(3)100 g C与石灰石的混合物充分反应后生成的气体在标况下的体积为11.2 L,100 g混合物中石灰石的质量分数是________。
【答案】SiO2+4HF===SiF4↑+2H2O SiO2+Na2CO3![]() Na2SiO3+CO2↑ Na2SiO3+CO2+H2O===Na2CO3+H2SiO3↓ D 50%
Na2SiO3+CO2↑ Na2SiO3+CO2+H2O===Na2CO3+H2SiO3↓ D 50%
【解析】
A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料——光导纤维,则A是Si元素,C是SiO2,C与烧碱反应生成含A元素的化合物D,D是Na2SiO3。
(1)SiO2是酸性氧化物,与一般的酸不能发生反应,但是可以与氢氟酸发生反应产生SiF4和氢气,发生反应的化学方程式是SiO2+4HF===SiF4↑+2H2O。
(2)将C与纯碱混合高温熔融时也发生化学反应生成D,同时还生成B的最高价氧化物E;则B是C,E是CO2,将全部的E与全部的D在足量的水中混合后,又发生化学反应生成含A的化合物F是H2SiO3。①生成D和F的化学方程式分别是:SiO2+Na2CO3![]() Na2SiO3+CO2↑,Na2SiO3+CO2+H2O===Na2CO3+H2SiO3↓。②要将NaOH高温熔化,由于NaOH是碱,可以与玻璃、石英中的酸性氧化物SiO2及两性氧化物氧化铝发生反应,腐蚀设备,故可选用铁坩埚,选项D正确。
Na2SiO3+CO2↑,Na2SiO3+CO2+H2O===Na2CO3+H2SiO3↓。②要将NaOH高温熔化,由于NaOH是碱,可以与玻璃、石英中的酸性氧化物SiO2及两性氧化物氧化铝发生反应,腐蚀设备,故可选用铁坩埚,选项D正确。
(3)根据反应方程式:SiO2+CaCO3![]() CaSiO3+CO2↑及CaCO3
CaSiO3+CO2↑及CaCO3![]() CaO+CO2↑可知:每100 g纯净的CaCO3发生反应,会产生1 mol CO2气体,在标准状况下体积是22.4 L,现在100 g C与石灰石的混合物充分反应后生成的气体在标况下的体积为11.2 L,n(CO2)="11.2" L÷22.4 L/mol="0.5" mol,则根据碳元素守恒可知n(CaCO3)="0.5" mol,其质量是m(CaCO3)="0.5" mol×100 g/mol="50" g,所以100 g混合物中石灰石的质量分数是(50 g÷100 g)×100%=50%。
CaO+CO2↑可知:每100 g纯净的CaCO3发生反应,会产生1 mol CO2气体,在标准状况下体积是22.4 L,现在100 g C与石灰石的混合物充分反应后生成的气体在标况下的体积为11.2 L,n(CO2)="11.2" L÷22.4 L/mol="0.5" mol,则根据碳元素守恒可知n(CaCO3)="0.5" mol,其质量是m(CaCO3)="0.5" mol×100 g/mol="50" g,所以100 g混合物中石灰石的质量分数是(50 g÷100 g)×100%=50%。


科目:高中化学 来源: 题型:
【题目】下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是( )
A. NH4Cl+NaOH=NaCl+NH3![]() +H2O B. Mg3N2+6H2O=3Mg(OH)2+2NH3
+H2O B. Mg3N2+6H2O=3Mg(OH)2+2NH3![]()
C. Cl2+2NaOH=NaClO+NaCl+H2O D. 2Na2O2+2H2O=NaOH+O2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列处置、操作或现象的描述中正确的是
①有大量的氯气泄漏时,应用浸有弱碱性溶液的毛巾捂住口鼻向高处跑
②用托盘天平称量50.56 g KCl,0.56 g通过移动游码来实现
③金属钠着火燃烧时,用泡沫灭火器灭火
④让一束光通过胶体,可以看到一条光亮的“通路”
A.③④B.②④C.①④D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在学习元素化合物知识的过程中,发现含有相同元素的物质间在一定条件下存在转化规律,绘制出如下转化关系图(部分反应物或产物略去),并用于研究物质A、B、C、D的性质及其变化。

(1)若A是黄绿色气体,X是生活中应用最大量的金属,D是白色固体。
① 组成A的元素在周期表中的位置是______。
② 下列说法正确的是______(填字母)。
a.C只具有还原性
b.B的水溶液中加入KSCN溶液,变为红色
c.若Y是碱,D放置在空气中会迅速变为灰绿色,最终变为红褐色
(2)若A、B、C、D的焰色反应均为黄色,X的固体俗称干冰。
① B转化为C的化学方程式是______。
② A用于呼吸面具或潜水艇中氧气的来源,则A和X反应生成1 mol B时,转移电子的物质的量为______ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84”消毒液在日常生活中使用广泛,该消毒液无色,有漂白作用。它的有效成份是下列物质中的一种,这种物质是
A.KMnO4B.Na2O2C.NH3·H2OD.NaClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
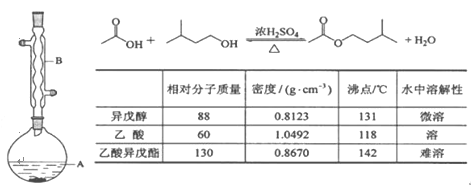
实验步骤:
在A 中加入 4.4 g 异戊醇、6.0 g 乙酸、数滴浓硫酸和 2~3 片碎瓷片。开始缓慢加热 A,回流 50 min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水 MgSO4 固体,静置片刻,过滤除去 MgSO4固体,进行蒸馏纯化,收集 140~143 ℃馏分,得乙酸异戊酯 3.9 g。
(1)仪器 B 的名称是________________。
(2)在洗涤操作中,第一次水洗的主要目的是____________________________________,第二次水洗的主要目的是________________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后________(填序号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是___________________________________________。
(5)实验中加入少量无水MgSO4 的目的是________。
(6)本实验的产率是________(填标号)。
a.30% b.40% c.60% d.90%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体:
①D的化学式是________;
②在工业生产中,B气体的大量排放被雨水吸收后形成了________而污染了环境。
(2)若A在常温下为气体,C是红棕色的气体:
①A、C的化学式分别是:A________;C________。
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式_______________________________________________。该反应________(填“属于”或“不属于”)氧化还原反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 100 mL 0.1 mol L-1 FeCl3 溶液和 200 mL 0.3 mol L-1 NaCl 溶液混合后(不考虑混合后溶液总体积的变化),则混合液中Cl-的浓度是
A.0.1 molL-1B.0.3 mol L-1C.0.6 mol L-1D.0.4mol L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com