
【题目】已知A是一种装饰品的主要成分,根据如图转化关系,回答下列问题。
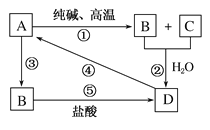
(1)A的用途为________(任写一种),B是________,D是________。
(2)写出化学方程式:
①________________________________________。
④________________________________________。
(3)写出离子方程式:
②___________________________________________。
③___________________________________________。
⑤___________________________________________。
【答案】 制光导纤维(合理即可) Na2SiO3 H2SiO3 Na2CO3+SiO2![]() Na2SiO3+CO2↑ H2SiO3
Na2SiO3+CO2↑ H2SiO3![]() H2O+SiO2 CO2+H2O+SiO32—=CO32—+H2SiO3↓ SiO2+2OH=SiO32—+H2O SiO32—+2H+=H2SiO3↓
H2O+SiO2 CO2+H2O+SiO32—=CO32—+H2SiO3↓ SiO2+2OH=SiO32—+H2O SiO32—+2H+=H2SiO3↓
【解析】
已知A是一种装饰品的主要成分,高温下和纯碱反应,A为SiO2,则B、C分别为Na2SiO3、CO2,二氧化碳在水溶液中和硅酸钠反应生成D为硅酸,硅酸受热分解生成二氧化硅,硅酸钠和盐酸反应生成硅酸,据此分析回答。
根据以上分析可知A为SiO2,B为Na2SiO3,C为CO2,D为硅酸。则
(1)A为二氧化硅可以做传递信号的光导纤维,根据以上分析可知B为Na2SiO3,D为H2SiO3;
(2)①是碳酸钠和二氧化硅高温反应生成硅酸钠和二氧化碳,反应的化学方程式为Na2CO3+SiO2![]() Na2SiO3+CO2↑;
Na2SiO3+CO2↑;
④反应为硅酸受热分解生成二氧化硅和水,反应的化学方程式为H2SiO3![]() H2O+SiO2;
H2O+SiO2;
(3)②发生的反应是二氧化碳和硅酸钠溶液反应生成硅酸沉淀的反应,离子方程式为CO2+H2O+SiO32—=CO32—+H2SiO3↓;
③反应为二氧化硅和氢氧化钠溶液反应生成硅酸钠和水,反应的离子方程式为SiO2+2OH=SiO32—+H2O;
⑤是硅酸钠和盐酸反应生成硅酸沉淀、氯化钠,反应的离子方程式为SiO32—+2H+=H2SiO3↓。


科目:高中化学 来源: 题型:
【题目】元素在元素周期表中的位置,反映了元素的原子结构和元素的性质,右图所示是元素周期表的一部分:

(1)元素N在元素周期表中的位置为第______周期________族。根据元素周期律,请预测H3AsO4、H3PO4的酸性强弱:H3AsO4_________ H3PO4 (填“>”“<”或“=”)。
(2)根据NaH的存在,有人提议可把氢元素放在ⅦA族,那么根据其最高正化合价与最低负化合价的绝对值相等,又可把氢元素放在元素周期表中的________族。
(3)元素甲是第3周期金属元素中原子半径最小的元素,该元素的离子与过量的氨水反应的离子方程式为_________________________。
(4)元素周期表中有10多种人体所需的微量元素,其中有一种被誉为“生命元素”的主族元素R,对延长人类寿命起着重要作用。已知R的原子有4个电子层,其最高价氧化物的分子式为RO3,则R的名称为______(填序号)。
A.硫 B.砷 C.硒 D.硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是( )
A. NH4Cl+NaOH=NaCl+NH3![]() +H2O B. Mg3N2+6H2O=3Mg(OH)2+2NH3
+H2O B. Mg3N2+6H2O=3Mg(OH)2+2NH3![]()
C. Cl2+2NaOH=NaClO+NaCl+H2O D. 2Na2O2+2H2O=NaOH+O2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前汽车上使用的电瓶大多仍是铅蓄电池,其构造示意图如下。发生反应的化学方程式为:Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(l),下列说法不正确的是
2PbSO4(s)+2H2O(l),下列说法不正确的是
A. 放电时,电解质溶液的pH值增大
B. 放电时,电路中转移0.2mol电子时Pb电极质量减少20.7g
C. 放电时,溶液中H+向PbO2电极移动
D. 放电时,正极反应为:PbO2(s)+4H+(aq)+SO42-(aq)+2e-=PbSO4(s)+2H2O(l)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.密闭容器中进行的反应N2+3H2![]() 2NH3△H < 0,在一定条件下达到平衡,只改变下列条件,按要求填空:
2NH3△H < 0,在一定条件下达到平衡,只改变下列条件,按要求填空:
(1)增大N2浓度,正反应速率________(填“加快”“减慢”或“不变”)。
(2)缩小容器的体积,增大压强,平衡_______移动(填“向左”“向右”或“不变”)
(3)升高温度,该反应的化学平衡常数(K)将________(填“增大”“减小”或“不变”)
II.有物质的量浓度相同的盐酸、硫酸、醋酸三种溶液:
(1)若三种溶液c(H+)依次为C1、C2、C3,则它们的大小关系为______________
(2)分别用以上三种酸中和等量的NaOH生成正盐,若需要酸溶液的体积依次为V1、V2、V3,则其大小关系是__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列哪种物质所含的原子数与0.5molH2O所含原子数相等( )
A.0.6molH2O2B.0.5molH2SO4C.1molHNO3D.1.5molHe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列处置、操作或现象的描述中正确的是
①有大量的氯气泄漏时,应用浸有弱碱性溶液的毛巾捂住口鼻向高处跑
②用托盘天平称量50.56 g KCl,0.56 g通过移动游码来实现
③金属钠着火燃烧时,用泡沫灭火器灭火
④让一束光通过胶体,可以看到一条光亮的“通路”
A.③④B.②④C.①④D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在学习元素化合物知识的过程中,发现含有相同元素的物质间在一定条件下存在转化规律,绘制出如下转化关系图(部分反应物或产物略去),并用于研究物质A、B、C、D的性质及其变化。

(1)若A是黄绿色气体,X是生活中应用最大量的金属,D是白色固体。
① 组成A的元素在周期表中的位置是______。
② 下列说法正确的是______(填字母)。
a.C只具有还原性
b.B的水溶液中加入KSCN溶液,变为红色
c.若Y是碱,D放置在空气中会迅速变为灰绿色,最终变为红褐色
(2)若A、B、C、D的焰色反应均为黄色,X的固体俗称干冰。
① B转化为C的化学方程式是______。
② A用于呼吸面具或潜水艇中氧气的来源,则A和X反应生成1 mol B时,转移电子的物质的量为______ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体:
①D的化学式是________;
②在工业生产中,B气体的大量排放被雨水吸收后形成了________而污染了环境。
(2)若A在常温下为气体,C是红棕色的气体:
①A、C的化学式分别是:A________;C________。
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式_______________________________________________。该反应________(填“属于”或“不属于”)氧化还原反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com