
【题目】元素在元素周期表中的位置,反映了元素的原子结构和元素的性质,右图所示是元素周期表的一部分:

(1)元素N在元素周期表中的位置为第______周期________族。根据元素周期律,请预测H3AsO4、H3PO4的酸性强弱:H3AsO4_________ H3PO4 (填“>”“<”或“=”)。
(2)根据NaH的存在,有人提议可把氢元素放在ⅦA族,那么根据其最高正化合价与最低负化合价的绝对值相等,又可把氢元素放在元素周期表中的________族。
(3)元素甲是第3周期金属元素中原子半径最小的元素,该元素的离子与过量的氨水反应的离子方程式为_________________________。
(4)元素周期表中有10多种人体所需的微量元素,其中有一种被誉为“生命元素”的主族元素R,对延长人类寿命起着重要作用。已知R的原子有4个电子层,其最高价氧化物的分子式为RO3,则R的名称为______(填序号)。
A.硫 B.砷 C.硒 D.硅
【答案】 2 ⅤA < ⅣA Al3++3NH3·H2O=Al(OH)3↓+3NH4+ C
【解析】本题考查位构性,(1)根据元素周期表的结构,N位于第二周期第VA族,非金属性越强,其最高价氧化物对应水化物酸性越强,同主族从上到下,非金属性减弱,即非金属性:P>As,酸性H3AsO4<H3PO4;(2)可以放在IVA族,如碳元素,最高价是+4价,最低价是-4价;(3)同周期从左向右原子半径依次减小,第三周期原子半径最小的金属元素是Al,氢氧化铝不溶于弱碱,即Al3++3NH3·H2O=Al(OH)3↓+3NH4+;(4)电子层数等于周期数,R原子有4个电子层,即R位于第四周期,R的最高价氧化物是RO3,即R显+6价,R位于VIA族,故选项C正确。


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】已知可逆反应aA+bB![]() cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是
cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是
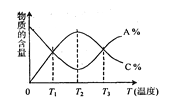
A.该反应在T1、T3温度时达到过化学平衡
B.该反应在T2温度时达到过化学平衡
C.该反应的逆反应是放热反应
D.升高温度,平衡会向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应:
3A(g)+B(g)![]() xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,
c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
(1)此时A的浓度c(A)=________mol/L,反应开始前容器中的A、B的物质的量:n(A)=n(B)=________mol;
(2)B的平均反应速率v(B)=________mol/(L·min);
(3)x的值为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D,E,F,G为7种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下,其中:B的离子半径大于E的离子半径;D是由极性键构成的4原子分子;C与F可形成D和G分子。
微粒 | A | B | C | D | E | F | G |
原子核数 | 单核 | 单核 | 多核 | 多核 | 单核 | 多核 | 多核 |
电荷数 | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
(1)A粒子的结构示意图是_________。
(2)用电子式表示D的形成过程: ________________________
(3)比较B与E相应元素的最高价氧化物对应水化物的碱性强弱,为______>_______(用化学式表示)。
(4)D与G反应的化学方程式是_________________。
(5)C粒子是_________,F粒子是_________(用电子式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用炭还原二氧化硅制得粗硅;
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl![]() SiHCl3+H2;
SiHCl3+H2;
③SiHCl3与过量H2在1000~1100 ℃反应制得纯硅。
已知:SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学方程式为_____________________。
(2)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
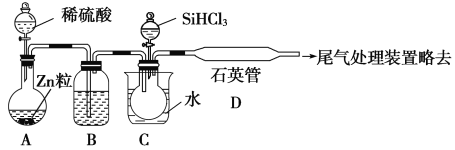
①装置B中的试剂是________。装置C中的烧瓶需要加热,其目的是_________________。
②反应一段时间后,装置D中观察到的现象是________________,装置D中发生反应的化学方程式为__________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及__________________________。
④SiHCl3的电子式为________,SiHCl3与H2O反应的化学方程式为:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g)![]() 2CO2(g)+S(l) ΔH<0,若反应在恒容的密闭容器中进行,下列有关说法正确的是
2CO2(g)+S(l) ΔH<0,若反应在恒容的密闭容器中进行,下列有关说法正确的是
A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,其他条件不变,分离出硫,正反应速率加快
C.平衡时,其他条件不变,升高温度可提高SO2的转化率
D.其他条件不变,使用不同催化剂,该反应的平衡常数不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com