
����Ŀ��һ�������£�ͨ�����з�Ӧ��ʵ��ȼú��������Ļ��գ�SO2(g����2CO(g��![]() 2CO2(g����S(l�� ��H<0������Ӧ�ں��ݵ��ܱ������н��У������й�˵����ȷ����
2CO2(g����S(l�� ��H<0������Ӧ�ں��ݵ��ܱ������н��У������й�˵����ȷ����
A��ƽ��ǰ�����ŷ�Ӧ�Ľ��У�������ѹǿʼ�ղ���
B��ƽ��ʱ�������������䣬�����������Ӧ���ʼӿ�
C��ƽ��ʱ�������������䣬�����¶ȿ����SO2��ת����
D�������������䣬ʹ�ò�ͬ�������÷�Ӧ��ƽ�ⳣ������

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ����Ԫ�����ڱ��е�λ�ã���ӳ��Ԫ�ص�ԭ�ӽṹ��Ԫ�ص����ʣ���ͼ��ʾ��Ԫ�����ڱ���һ���֣�

(1)Ԫ��N��Ԫ�����ڱ��е�λ��Ϊ��______����________�塣����Ԫ�������ɣ���Ԥ��H3AsO4��H3PO4������ǿ����H3AsO4_________ H3PO4 (���������������)��
(2)����NaH�Ĵ��ڣ���������ɰ���Ԫ�ط�����A�壬��ô��������������ϼ���������ϼ۵ľ���ֵ��ȣ��ֿɰ���Ԫ�ط���Ԫ�����ڱ��е�________�塣
(3)Ԫ�ؼ��ǵ�3���ڽ���Ԫ����ԭ�Ӱ뾶��С��Ԫ�أ���Ԫ�ص�����������İ�ˮ��Ӧ�����ӷ���ʽΪ_________________________��
(4)Ԫ�����ڱ�����10���������������Ԫ�أ�������һ�ֱ���Ϊ������Ԫ�ء�������Ԫ��R�����ӳ���������������Ҫ���á���֪R��ԭ����4�����Ӳ㣬�����������ķ���ʽΪRO3����R������Ϊ______(�����)��
A���� B���� C���� D����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���A1���仯�����˵����ȷ����
A��AlO3������ˮ��Ӧ����Al(OH)3
B����������ʹ������Ľ���
C��ʵ���ҳ���AlCl3��Һ��NaOH��Һ�Ʊ�Al(OH)3
D��Al���������Գ���ʢ�����ԡ����Ժ��̵�ʳ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ�����ڱ���һ���֣��ش������й����⣺
�� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A |
1 | �� | ||||||
2 | �� | �� | �� | �� | |||
3 | �� | �� | �� | �� | �� | ||
4 |
|
|
��1����ˮ��Ӧ����ҵĽ���Ԫ����_____��Ԫ�ع��ɵ����ȶ���̬�⻯��Ļ�ѧʽ��_________���ۡ��ܡ���Ԫ��ԭ�Ӱ뾶�ɴ�С��_____________����Ԫ�ط��ű�ʾ����
��2��д��Ԫ�آߵĵ����������������ˮ���ﷴӦ�����ӷ���ʽ______________.
��3���ڡ�������Ԫ���γ�ij���廯�����ǵ�������ЧӦ����Ҫԭ�û�����ĵ���ʽΪ_____________��Ԫ�آ��γ�һ�ּ���������õ���ʽ��ʾ�ü�����������γɹ���______________________��
��4���ڵĵ�����������������ˮ�����Ũ��Һ��Ӧ��ѧ����ʽ____________________.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��A��B��C��D��E��ԭ��������������A��Cͬ�壬B��Dͬ�壬C���Ӻ�B���Ӿ�����ͬ�ĵ��Ӳ�ṹ��A��B��D��E�����γɹ����ͻ����A��B�γɵĻ�������ˮ�гʼ��ԣ�C��E�γɵĻ�������ˮ�г����ԣ��ش��������⣺
��1������Ԫ���У�ԭ�Ӱ뾶������ ���ǽ�������ǿ���� (��Ԫ�ط���)��
��2����A��B��D��E���γɵĹ����ͻ������У����ȶ���������____________(�û�ѧʽ��ʾ)��
��3��A��E�γɵĻ�������A��B�γɵĻ����ﷴӦ������ĵ���ʽΪ____________��
��4��E������������ˮ����Ļ�ѧʽΪ____________��
��5������C�ڿ�����ȼ�յIJ�����ڵĻ�ѧ������Ϊ ���䷴Ӧ��ѧ����ʽΪ ��
��6������E��ˮ��Ӧ�����ӷ���ʽΪ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���е�λ���õ绯ѧԭ����SO2���Ʊ����ᣬװ������ͼ������ij�ִ������缫Ϊ��IJ��ϣ����������壬ͬʱҲ��ʹ������������Һ��ֽӴ���
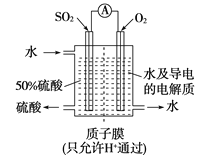
��1��ͨ��SO2�ĵ缫Ϊ__________������缫��ӦʽΪ_________________���˵缫��pH_______(�������С�����䡱����
��2����ͨ��SO2������Ϊ2.24 L/min����״������Ϊ�ȶ�����������������Һ��Ũ��Ӧά�ֲ��䣬�����ˮ������������ ������� mL/min��ʾ��
��3���Դ˵�Դ�����������������Һ�����������������Ϊ21.6 g�����������������״�������Ϊ__________L��
��4������ʱ��BaSO4��Ksp=1.08��10-10���ֽ��������BaCl2��Һ��3.5��10-3mol/L��Na2SO4��Һ��ϡ���Ҫ����BaSO4������BaCl2��Һ����СŨ��Ϊ________��
��5����֪��Fe2O3(s����3C(ʯī��==2Fe(s����3CO(g�� ��H =+489.0 kJ��mol-1
CO(g����1/2O2(g��==CO2(g�� ��H=��283.0 kJ��mol-1
C(ʯī����O2(g��==CO2 (g�� ��H=��393.5 kJ��mol-1
��4Fe(s����3O2(g��==2Fe2O3(s���Ħ�HΪ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�Ȼ��������Ȼ����Ļ�����Ҫ�ⶨ������Ԫ�ص���������������ͼ�������ʵ�飺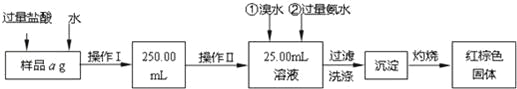
������������̣��ش��������⣺
��1����Ʒ�ܽ�����м�������Ũ�����Ŀ����ʲô��
���������õ��IJ����������ձ����������⣬����������Щ������
�������п��õIJ���������ʲô������
��2����д�����백ˮ���������ӷ�Ӧ����ʽ��
��3������ϴ�ӵķ�����ʲô��
��4�������������գ���ȴ�����£�����ƽ����������Ϊb1g���ٴ����ղ���ȴ�����³���������Ϊb2g����b1��b2=0.3g�����������Ӧ���еIJ����� ����������������W1g������������Ⱥ������������W2g������Ʒ����Ԫ�ص����������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС����Ƴ���ͼ��ʾװ�����Ľ��̲��С�ͭ�����ᷴӦ��ʵ�飬��̽����ѧʵ�����ɫ����

��1��ʵ��ǰ���رջ���b���Թ�d�м�ˮ����û�����ܿڣ������Թ�c��d�Ľ���������c����Ŀ����_____________________________��
��2����d�м�����NaOH��Һ��c�з�һС��ͭƬ���ɷ�Һ©��a��c�м���2 mLŨ���ᡣc�з�Ӧ�Ļ�ѧ����ʽ��____________________������a��c�м�2 mL����ˮ��c�е�ʵ�������� ___________________________��
��3���±�����ȡ����ͭ�����ַ�������������ɫ��ѧ�������ѷ�����_____________��������_____________��
���� | ��Ӧ�� |
�� | Cu��ŨHNO3 |
�� | Cu��ϡHNO3 |
�� | Cu��O2��ϡHNO3 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com