
【题目】某氯化亚铁和氯化铁的混合物.现要测定其中铁元素的质量分数,按如图步骤进行实验: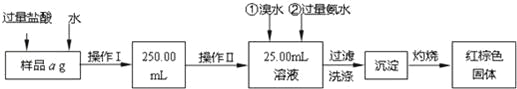
请根据以上流程,回答下列问题:
(1)样品溶解过程中加入少量浓盐酸的目的是什么?
操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有哪些仪器?
操作Ⅱ中可用的玻璃仪器是什么仪器?
(2)请写出加入氨水发生的离子反应方程式。
(3)沉淀洗涤的方法是什么?
(4)将沉淀物灼烧,冷却到室温,用天平称量其质量为b1g,再次灼烧并冷却至室温称量其质量为b2g,若b1﹣b2=0.3g,则接下来还应进行的操作是 .若蒸发皿质量是W1g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是 .
【答案】(1)抑制亚铁离子和铁离子的水解;胶头滴管和250mL容量瓶;酸式滴定管或移液管
(2)Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+
(3)向过滤器中加蒸馏水至沉淀表面浸没,自然滤出,重复此操作2~3次
(4)继续加热,冷却至室温时,称量,直至两次连续称量质量差不超过0.1g;![]()
【解析】试题分析:(1)铁离子和亚铁离子均易水解,所以加入浓盐酸的作用是抑制亚铁离子和铁离子的水解;因配制一定物质的量浓度的溶液所需要的仪器有:量筒、胶头滴管、烧杯、玻璃棒、一定规格的容量瓶,所以还需要的仪器有250mL容量瓶和胶头滴管;操作Ⅱ是量取25.00mL溶液,由于溶液显酸性,所以需要的仪器是酸式滴定管或移液管;
(2)溴水具有强氧化性,能把亚铁离子氧化生成铁离子,然后加入氨水沉淀铁离子,反应的离子方程式Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+。
(3)洗涤沉淀的方法是向过滤器中加蒸馏水至沉淀表面浸没,自然滤出,重复此操作2~3次;
(4)为了减少误差,需再次加热冷却并称量,直至两次质量差小于0.1g;因铁元素质量守恒,即红棕色固体中的铁就是样品中铁,Fe2O3中铁元素的质量为![]() 。
。


科目:高中化学 来源: 题型:
【题目】晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用炭还原二氧化硅制得粗硅;
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl![]() SiHCl3+H2;
SiHCl3+H2;
③SiHCl3与过量H2在1000~1100 ℃反应制得纯硅。
已知:SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学方程式为_____________________。
(2)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
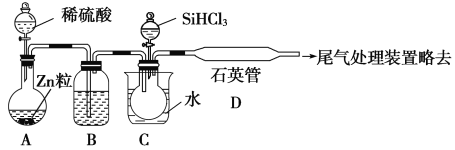
①装置B中的试剂是________。装置C中的烧瓶需要加热,其目的是_________________。
②反应一段时间后,装置D中观察到的现象是________________,装置D中发生反应的化学方程式为__________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及__________________________。
④SiHCl3的电子式为________,SiHCl3与H2O反应的化学方程式为:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[有机化学基础]H是一种香料的成分之一,其结构中含有三个六元环。G的结构简式为![]() ,H的合成路线如下(部分产物和反应条件略去):
,H的合成路线如下(部分产物和反应条件略去):
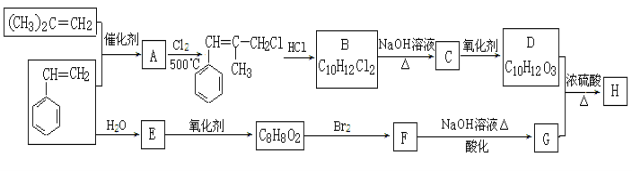
已知:① B中核磁共振氢谱图显示分子中有6种不同环境的氢原子。
②![]()
③D和G是同系物
(1)用系统命名法命名(CH3)2C=CH2 。
(2)A→B反应过程中涉及的反应类型有 。
(3)G分子中含氧官能团的名称: 。
(4)写出B与足量氢氧化钠溶液在加热条件下反应的化学方程式: 。
(5)写出F的结构简式: 。
(6)同时满足下列3个条件:①与FeCl3溶液发生显色反应;②能发生水解反应;③苯环上有两个取代基的G的同分异构体有 种(不包括立体异构),其中核磁共振氢谱为5组峰的为 (写结构简式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g)![]() 2CO2(g)+S(l) ΔH<0,若反应在恒容的密闭容器中进行,下列有关说法正确的是
2CO2(g)+S(l) ΔH<0,若反应在恒容的密闭容器中进行,下列有关说法正确的是
A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,其他条件不变,分离出硫,正反应速率加快
C.平衡时,其他条件不变,升高温度可提高SO2的转化率
D.其他条件不变,使用不同催化剂,该反应的平衡常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X的原子,其M层与K层电子数相同;元素Y的原子,其L层上有5个电子。X和Y所形成的稳定化合物的摩尔质量为
A.148g·mol-1 B.100g·mol-1 C.90g·mol-1 D.38g·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列鉴别物质的方法能达到目的的是
A用氨水鉴别用氨水鉴别MgCl2溶液和AlCl3溶液
A. 用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液
B. 用KSCN溶液鉴别FeCl3溶液和FeCl2溶液
C. 用淀粉溶液鉴别加碘盐和未加碘盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于SO2气体的叙述中,正确的是( )
A.SO2的摩尔质量是64 g
B.1mol SO2中所含分子数约为6.02×1023
C.1 mol SO2的质量是64 g·mol-1
D.25℃,1.01×105Pa下,1 mol SO2的体积为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液的叙述正确的是
A.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-)
B.在pH=3的溶液中,Na+、Cl-、Fe2+、ClO-可大量共存
C.常温下,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.向0.1mol·L-1的氨水中加入少量硫酸铵固体,则溶液中![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修5:有机化学基础】化合物E是一种医药中间体,常用于制备抗凝血药,可以通过下图所示的路线合成:
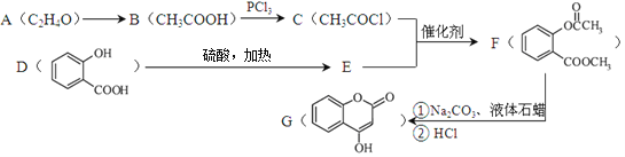
(1)G中含有的官能团名称为 。
(2)B→C的反应类型是 。
(3)1 mol D最多可与 mol H2加成。写出D→E的化学方程式 。
(4)写出同时满足下列条件的D的一种同分异构体的结构简式 。
A.能发生银镜反应
B.核磁共振氢谱只有4个峰
C.能与FeCl3溶液发生显色反应,水解时1 mol可消耗3 mol NaOH
(5)已知工业上以氯苯水解制取苯酚,而酚羟基一般不易直接与羧酸酯化。甲苯可被酸性高锰酸钾溶液氧化为苯甲酸。苯甲酸苯酚酯(![]() )是一种重要的有机合成中间体。试写出以苯酚、甲苯为原料制取该化合物的合成路线流程图(无机原料任选)。合成路线流程图示例如
)是一种重要的有机合成中间体。试写出以苯酚、甲苯为原料制取该化合物的合成路线流程图(无机原料任选)。合成路线流程图示例如![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com