
����Ŀ���������һ����Ҫ�ķǽ������ϣ��Ʊ��������Ҫ�������£�
����������̿��ԭ���������Ƶôֹ裻
���ֹ������HCl���巴Ӧ�Ƶ�SiHCl3��Si��3HCl![]() SiHCl3��H2��
SiHCl3��H2��
��SiHCl3�����H2��1000��1100 ����Ӧ�Ƶô��衣
��֪��SiHCl3����H2Oǿ�ҷ�Ӧ���ڿ���������ȼ��
��ش��������⣺
��1���������Ʊ��ֹ�Ļ�ѧ����ʽΪ_____________________��
��2����SiHCl3�����H2��Ӧ�Ʊ������װ������(��Դ���г�װ����ȥ):
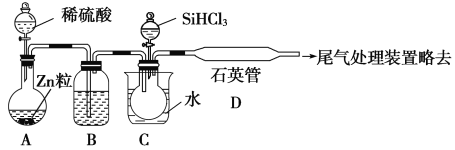
��װ��B�е��Լ���________��װ��C�е���ƿ��Ҫ���ȣ���Ŀ����_________________��
����Ӧһ��ʱ���װ��D�й۲쵽��������________________��װ��D�з�����Ӧ�Ļ�ѧ����ʽΪ__________________________��
��Ϊ��֤�Ʊ�����ʵ��ijɹ��������Ĺؼ��Ǽ��ʵ��װ�õ������ԣ����ƺ÷�Ӧ�¶��Լ�__________________________��
��SiHCl3�ĵ���ʽΪ________��SiHCl3��H2O��Ӧ�Ļ�ѧ����ʽΪ��_________________��
���𰸡���1��SiO2��2C![]() Si��2CO����
Si��2CO����
��2����Ũ���ʹ������ƿ�е�SiHCl3��������ʯӢ�ܷ�Ӧ��
���лҺ�ɫ�����������ɣ�SiHCl3��H2![]() Si��3HCl��
Si��3HCl��
���ž�װ���еĿ�����
��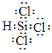 ��SiHCl3��3H2O=H2SiO3����3HCl+H2����SiHCl3��4H2O=H4SiO4����3HCl+H2����
��SiHCl3��3H2O=H2SiO3����3HCl+H2����SiHCl3��4H2O=H4SiO4����3HCl+H2����
��������
�����������1���ֹ��Ʊ�����C��SiO2��Ӧ�Ʊ�����Ӧ����ʽΪ��SiO2��2C![]() Si��2CO������2����SiHCl3��ˮ����ǿ�ҷ�Ӧ����˱���ˮ���룬���B��ʢ��Ũ���ᣬ����H2�е�ˮ������������ƿ�е�SiHCl3��������ʯӢ�ܷ�Ӧ����SiHCl3��H2
Si��2CO������2����SiHCl3��ˮ����ǿ�ҷ�Ӧ����˱���ˮ���룬���B��ʢ��Ũ���ᣬ����H2�е�ˮ������������ƿ�е�SiHCl3��������ʯӢ�ܷ�Ӧ����SiHCl3��H2 ![]() Si��3HCl���лҺ�ɫ�����������ɣ��������ǿ�ȼ�����壬�����������������ը�����Ҫ�ž�װ�õĿ��������ο�SiCl4�Ľṹ��SiHCl3�ĵ���ʽΪ��
Si��3HCl���лҺ�ɫ�����������ɣ��������ǿ�ȼ�����壬�����������������ը�����Ҫ�ž�װ�õĿ��������ο�SiCl4�Ľṹ��SiHCl3�ĵ���ʽΪ��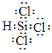 ����ˮ���ҷ�Ӧ���ڿ���������ȼ��˵��������ȼ�����壬SiHCl3��3H2O = H2SiO3����3HCl + H2����
����ˮ���ҷ�Ӧ���ڿ���������ȼ��˵��������ȼ�����壬SiHCl3��3H2O = H2SiO3����3HCl + H2����


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У�����ȱ��ֳ�ǿ�����ԣ��ֱ��ֳ����Ե��ǣ� ��
A.ϡ������п����Ӧ��������
B.Ũ����ʹ�������ۻ�
C.Ũ������ͭ��Ӧ���ȷ�Ӧ����SO2
D.Ũ�����ľ̿�ڼ��������·�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����ѧϰС����ճ������в���ȱ�ٵĵ�ζƷM����̽������֪C����D��ȼ�շ�����ɫ���森M���������ʵ�ת����ϵ��ͼ��ʾ�����ֲ�������ȥ����
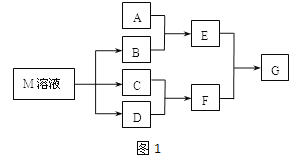
��1��д��F�ĵ���ʽ ��
��2����A��һ�ֳ���������������ҿ��������첣����E��Һ��F��Һ��Ӧ�����Ʊ�һ�ֽ��壬��E��Һ���׳���___________
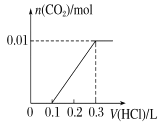
��3����A��CO2���壬A��B��Һ�ܹ���Ӧ����Ӧ�����õ���Һ�������ᷴӦ����ͼ��ʾ����A��B��Һ��Ӧ����Һ�е����ʻ�ѧʽΪ ��
��4����A��һ�ֳ����������ʣ���A��B��Һ�ܹ���Ӧ��������F��Һ��μ���E��Һ���ӱ�����������ʵ�������� ��
��5����A��һ�ֻ��ʣ�ʵ���ҿ���A��B��Ӧ��ȡ����E��E��F��E��D������ð���̣�������E ��D�ķ�Ӧ��������D�Ĺܵ��Ƿ�й¶��д��E��D��Ӧ�Ļ�ѧ����ʽ�� ��
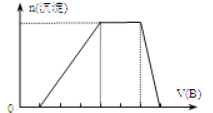
��6����A��һ����Һ��ֻ���ܺ���H+��NH4+��Mg2+��Fe3+��Al3+��CO32����SO42���е�ijЩ���ӣ��������Һ�м���B��Һʱ�������ɳ��������ʵ�����B��Һ����������仯��ͼ.��ʾ���ɴ˿�֪������Һ�п϶����е����Ӽ���Ũ��֮��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ����Ԫ�����ڱ��е�λ�ã���ӳ��Ԫ�ص�ԭ�ӽṹ��Ԫ�ص����ʣ���ͼ��ʾ��Ԫ�����ڱ���һ���֣�

(1)Ԫ��N��Ԫ�����ڱ��е�λ��Ϊ��______����________�塣����Ԫ�������ɣ���Ԥ��H3AsO4��H3PO4������ǿ����H3AsO4_________ H3PO4 (���������������)��
(2)����NaH�Ĵ��ڣ���������ɰ���Ԫ�ط�����A�壬��ô��������������ϼ���������ϼ۵ľ���ֵ��ȣ��ֿɰ���Ԫ�ط���Ԫ�����ڱ��е�________�塣
(3)Ԫ�ؼ��ǵ�3���ڽ���Ԫ����ԭ�Ӱ뾶��С��Ԫ�أ���Ԫ�ص�����������İ�ˮ��Ӧ�����ӷ���ʽΪ_________________________��
(4)Ԫ�����ڱ�����10���������������Ԫ�أ�������һ�ֱ���Ϊ������Ԫ�ء�������Ԫ��R�����ӳ���������������Ҫ���á���֪R��ԭ����4�����Ӳ㣬�����������ķ���ʽΪRO3����R������Ϊ______(�����)��
A���� B���� C���� D����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯�����������������й㷺Ӧ�á�
��1����֪��CO�ɽ����ֵ��������ﻹԭΪN2��
��Ӧ����2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ��H = ��746 kJ��mol��1
N2(g)+2CO2(g) ��H = ��746 kJ��mol��1
��Ӧ����4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) ��H = ��1200 kJ��mol��1
N2(g)+4CO2(g) ��H = ��1200 kJ��mol��1
д��CO��NO2��ԭΪNO���Ȼ�ѧ����ʽ ��
��2����һ���Ⱥ��ݵ������г���2mol CO��1mol NO2����������ӦII��������˵����Ӧ�ﵽƽ��״̬���� �� ��
A�������ڵ���ѹǿ���ڱ仯 B��������CO��NO2���ʵ����Ȳ���
C������������ƽ���ܶȲ��� D�������������¶Ⱥ㶨����
��3�����ܱ������г���5 mol CO��4 mol NO����������ӦI����ͼΪƽ��ʱNO������������¶ȡ�ѹǿ�Ĺ�ϵ��
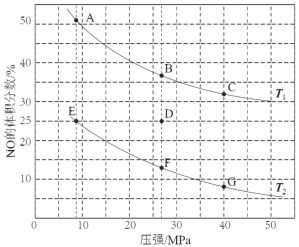
�ش��������⣺
���¶ȣ�T1 T2����������� ����
��ij�¶��£������Ϊ2 L���ܱ������У���Ӧ����10���ӷų�����373 kJ����CO��Ũ�ȱ仯��ʾ��ƽ����Ӧ����v(CO)= ��
������D��Է�Ӧ�������µ�ͬʱ�������ʹ��ϵѹǿ��С�����´ﵽ��ƽ��״̬������ͼ��A~G���е� ��
��4��ij�¶�ʱ����������AgNO2�� Ksp= 9.0��10-4��Ag2SO4��Ksp=4.0��10-5������NO2����SO42�������Һ�м���AgNO3��Һ��SO42��ǡ����ȫ��������SO42��Ũ�ȵ���1.0��10-5 mol��L-1��ʱ��c(NO2��)= mol��L��1��
��5������ͼ�������������£����ˮ��CN-��ת��ΪCO2��N2����д�������ĵ缫��Ӧʽ ��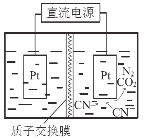
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ǵ���ʳס���ж��̺��ŷḻ�Ļ�ѧ֪ʶ������˵������ȷ���ǣ� ��
A.�����еIJ�˿�͵��ڶ����ںϳ��л��߷��Ӳ���
B.�ӵ�ʳ�κ���ǿ�����Ͷ����Բ�������������Ԫ��
C.������¥����ʱ�õ��ĸ��Ǵ�����
D.��Һ��ʯ������������������ȼ�ϣ�������ɿ�����Ⱦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵķе��ɸߵ������е�˳����
��CH3(CH2)2CH3��CH3(CH2)3CH3��(CH3)3CH��(CH3)2CHCH2CH3��(CH3CH2)2CHCl
A���ݢڢܢ٢� B���ܢڢݢ٢� C���ݢܢڢ٢� D���ڢܢݢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���A1���仯�����˵����ȷ����
A��AlO3������ˮ��Ӧ����Al(OH)3
B����������ʹ������Ľ���
C��ʵ���ҳ���AlCl3��Һ��NaOH��Һ�Ʊ�Al(OH)3
D��Al���������Գ���ʢ�����ԡ����Ժ��̵�ʳ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�Ȼ��������Ȼ����Ļ�����Ҫ�ⶨ������Ԫ�ص���������������ͼ�������ʵ�飺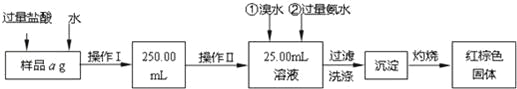
������������̣��ش��������⣺
��1����Ʒ�ܽ�����м�������Ũ�����Ŀ����ʲô��
���������õ��IJ����������ձ����������⣬����������Щ������
�������п��õIJ���������ʲô������
��2����д�����백ˮ���������ӷ�Ӧ����ʽ��
��3������ϴ�ӵķ�����ʲô��
��4�������������գ���ȴ�����£�����ƽ����������Ϊb1g���ٴ����ղ���ȴ�����³���������Ϊb2g����b1��b2=0.3g�����������Ӧ���еIJ����� ����������������W1g������������Ⱥ������������W2g������Ʒ����Ԫ�ص����������� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com