
【题目】下列反应中,硫酸既表现出强氧化性,又表现出酸性的是( )
A.稀硫酸与锌粒反应生成气体
B.浓硫酸使铁、铝钝化
C.浓硫酸与铜反应加热反应产生SO2
D.浓硫酸和木炭在加热条件下反应
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】常温下,一定浓度的某溶液,由水电离的出的c(OH-)=1×10-4 mol/L,则该溶液中的溶质可能是
A.H2SO4 B.NaOH C.KHSO4 D.CH3COONa
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—物质结构与性质】如右图是元素周期表的一部分。已知R的核电荷数小于36,气态氢化物沸点:MHn>YHn。
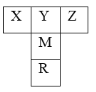
(1)表中五种元素第一电离能最大的是 (填元素符号),Y的最简单氢化物分子的空间构型为 ,基态R原子中有 个未成对电子。
(2)Y的最高价氧化物熔点比M的最高价氧化物熔点低,原因是 ,YZ-中σ键与π键的个数比为 。
(3)YO32-中Y原子的杂化方式是 ,写出一种与YO32-互为等电子体的粒子 (用化学符号表示)。
(4)Z的一种常见氢化物能与硫酸铜反应生成配合物。请用结构简式表示该配合物中的阳离子: 。
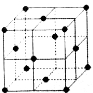
(5)如图为某金属单质的面心立方晶胞结构示意图,该晶体中配位数是 ;测得此晶体的密度为2.7g.cm-3,晶胞的边长为0.405nm,则此金属原子的相对原子质量为 (结果保留整数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用pH试纸测定某无色溶液的pH时,规范的操作是( )
A.将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较
B.将溶液倒在pH试纸上,跟标准比色卡比较
C.用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较
D.在试管内放入少量溶液,煮沸,把pH试纸放在管口,观察颜色,跟标准比色卡比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是短周期元素,其部分性质如下表:
W | 单质是淡黄色固体 |
X | 在地壳中的含量居第二位 |
Y | 原子最外层电子数是电子总数的2/3 |
Z | 第3周期原子半径最小的金属 |
下列说法正确的是
A. 气态氢化物的热稳定性:X>W
B. 非金属性:Y < W;离子半径:Z > W
C. W在空气中充分燃烧所得产物,可用于杀菌消毒
D. 金属Z与少量NaOH溶液反应,生成两性氢氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)图表法是常用的科学研究方法,下表列出了同周期的四种短周期元素的部分性质(“电负性”即元素对应原子吸引电子能力的标度):
元素编号 | A | B | C | D | E |
电负性 | 3.0 | 2.5 | X[ | 1.5 | 0.9 |
原子半径(单位nm) | 0.099 | 0.102 | 0.110 | 0.143 | 0.186 |
主要化合价 | -1,+7 | -2,+6 | -3,+5 | +3 | +1 |
请回答下列问题:
(1)写出E元素的离子结构示意图 ;
(2)X的值应为 (填字母);
A.3.6 B.3.1 C.2.1 D.1.4
(3)分析表中数据,简述同周期元素(除惰性气体)电负性大小与原子半径的关系 ;
(4)A、B、C三种元素形成的氢化物中,其稳定性由强到弱的顺序是: (用化学式表示)
(5)A、D最高价氧化物对应水化物相互反应的化学方程式:
(6)D、E最高价氧化物对应水化物相互反应的离子方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可逆反应aA+bB![]() cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是
cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是
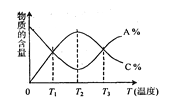
A.该反应在T1、T3温度时达到过化学平衡
B.该反应在T2温度时达到过化学平衡
C.该反应的逆反应是放热反应
D.升高温度,平衡会向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用炭还原二氧化硅制得粗硅;
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl![]() SiHCl3+H2;
SiHCl3+H2;
③SiHCl3与过量H2在1000~1100 ℃反应制得纯硅。
已知:SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学方程式为_____________________。
(2)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
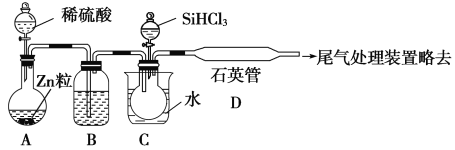
①装置B中的试剂是________。装置C中的烧瓶需要加热,其目的是_________________。
②反应一段时间后,装置D中观察到的现象是________________,装置D中发生反应的化学方程式为__________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及__________________________。
④SiHCl3的电子式为________,SiHCl3与H2O反应的化学方程式为:_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com