
【题目】目前汽车上使用的电瓶大多仍是铅蓄电池,其构造示意图如下。发生反应的化学方程式为:Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(l),下列说法不正确的是
2PbSO4(s)+2H2O(l),下列说法不正确的是
A. 放电时,电解质溶液的pH值增大
B. 放电时,电路中转移0.2mol电子时Pb电极质量减少20.7g
C. 放电时,溶液中H+向PbO2电极移动
D. 放电时,正极反应为:PbO2(s)+4H+(aq)+SO42-(aq)+2e-=PbSO4(s)+2H2O(l)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】铁及其化合物在有机化学中应用广泛,例如有机合成中,常用铁和盐酸将硝基(﹣NO2)还原为氨基(﹣NH2);在苯的溴代反应中用溴化铁作催化剂。
(1)N的原子结构示意图为_______,Fe基态原子核外电子排布式为_______。
(2)H、N、O 的电负性从小到大的顺序是_______。
(3)与NO2+互为等电子体的一种分子为_____(填化学式),氨基(﹣NH2)中氮原子的杂化类型为_____。
(4)1mol苯分子中含有σ键的物质的量为______。
(5)Fe 与 N 形成的某化合物晶胞如图所示,则该晶体的化学式为_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按下图所示装置进行实验,并回答下列问题:

(1)锌极发生反应的电极反应式为_______________________________;铜极发生反应的电极反应式为_______________________________________________;
(2)石墨棒C1发生反应的电极反应式为____________________________;石墨棒C2附近发生的实验现象为____________________________________________。
(3)当C2极析出224 mL气体(标准状况)时,锌的质量减少_____g,CuSO4溶液的质量________(填“增加”或“减少”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )

A. 反应CH4+H2O![]() 3H2+CO,每消耗1molCH4转移8mol电子
3H2+CO,每消耗1molCH4转移8mol电子
B. 电极A上H2参与的电极反应为:H2+CO32--2e-=H2O+CO2
C. 电池工作时,CO32-向电极B移动
D. 用电器上每通过4mol电子,电极B上参加反应的O2为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应的本质是旧健的断裂和新健的形成过程,化学键的键能是形成(或拆开)1mol化学键进释放(或吸收)的能量。已知白磷(P4)和P4O6分子结构如下图所示,现提供以下化学键的键能(kJ/mol)P-P:a,P-O:b,O=O:d(a、b、d均为正数)。则反应P4(白磷)+3O2=P4O6的能量变化为( )

A. 吸收(6a-12b)kJ的能量
B. 释放(6a-12b)kJ的能量
C. 释放(12b-6a-3d)kJ的能量
D. 吸收(6a+3d-12b)kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
Ⅰ.[查阅资料]
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水。其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合液中通入SO2可制得Na2S2O3,所得产品中常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl。
(4)硫代硫酸钠与碘反应的离子方程式为:2S2O32-+I2=S4O62-+2I-
Ⅱ.[制备产品]实验装置如图所示(省略夹持装置)
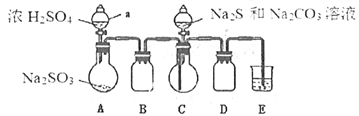
实验步骤:
(1)按如图所示组装好装置后,应先_______________(填操作名称),再按图示加入试剂。仪器B和D的作用是____________________________;E中的试剂是__________(选填下列字母编号)。
A.稀H2SO4 B.NaOH溶液 C.饱和NaHSO3溶液
(2)先向烧瓶C中加入Na2S和Na2CO3混合溶液,再向烧瓶A中滴加浓H2SO4。C中反应生成Na2S2O3和CO2,化学方程式为______________________。
(3)待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合液,滤液经蒸发、结晶、过滤、洗涤、干燥、得到产品。
Ⅲ.[探究与反思]
(1)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择):
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,____________,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(2)用I2的标准溶液测定产品的纯度
取10.0g产品,配制成100mL溶液,配制溶液的蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除__________及二氧化碳。取10.00mL溶液。以________溶液为指示剂,用浓度为0.10mol/LI2的标准溶波进行滴定,相关数据记录如下表所示。
编号 | 1 | 2 | 3 |
溶液的体积/mL | 10.00 | 10.00 | 10.00 |
消耗I2标准溶液的体积/mL | 19.95 | 17.10 | 20.05 |
滴定时,达到滴定终点的现象是___________________________________________。Na2S2O3·5H2O在产品中的质量分数是_______________(用百分数表示,且保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种装饰品的主要成分,根据如图转化关系,回答下列问题。
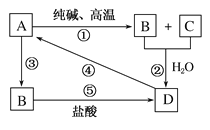
(1)A的用途为________(任写一种),B是________,D是________。
(2)写出化学方程式:
①________________________________________。
④________________________________________。
(3)写出离子方程式:
②___________________________________________。
③___________________________________________。
⑤___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中加入浓度均为0.2 mol·L1的CO和H2O,T℃发生如下反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g)。下列说法能充分说明该反应已经达到化学平衡状态的是
CO2(g)+H2(g)。下列说法能充分说明该反应已经达到化学平衡状态的是
A. 正、逆反应速率都等于零
B. CO、H2O、CO2和H2 的浓度相等
C. CO、H2O、CO2和H2 的浓度不再变化
D. 单位时间内消耗1 molCO同时生成1 molCO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用下图所示装置检验浓硫酸与木炭反应的各种产物。
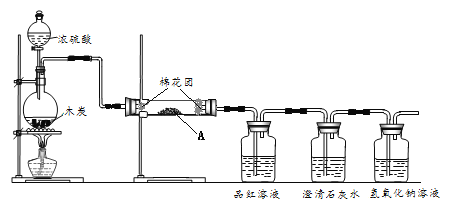
请回答:
(1)浓硫酸与木炭反应的化学方程式是______。
(2)试剂A是______。
(3)品红溶液的作用是______。
(4)澄清石灰水变浑浊,能否一定说明生成二氧化碳,理由是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com