
【题目】硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
Ⅰ.[查阅资料]
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水。其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合液中通入SO2可制得Na2S2O3,所得产品中常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl。
(4)硫代硫酸钠与碘反应的离子方程式为:2S2O32-+I2=S4O62-+2I-
Ⅱ.[制备产品]实验装置如图所示(省略夹持装置)
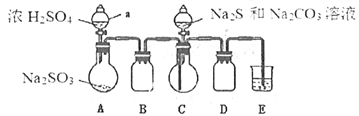
实验步骤:
(1)按如图所示组装好装置后,应先_______________(填操作名称),再按图示加入试剂。仪器B和D的作用是____________________________;E中的试剂是__________(选填下列字母编号)。
A.稀H2SO4 B.NaOH溶液 C.饱和NaHSO3溶液
(2)先向烧瓶C中加入Na2S和Na2CO3混合溶液,再向烧瓶A中滴加浓H2SO4。C中反应生成Na2S2O3和CO2,化学方程式为______________________。
(3)待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合液,滤液经蒸发、结晶、过滤、洗涤、干燥、得到产品。
Ⅲ.[探究与反思]
(1)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择):
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,____________,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(2)用I2的标准溶液测定产品的纯度
取10.0g产品,配制成100mL溶液,配制溶液的蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除__________及二氧化碳。取10.00mL溶液。以________溶液为指示剂,用浓度为0.10mol/LI2的标准溶波进行滴定,相关数据记录如下表所示。
编号 | 1 | 2 | 3 |
溶液的体积/mL | 10.00 | 10.00 | 10.00 |
消耗I2标准溶液的体积/mL | 19.95 | 17.10 | 20.05 |
滴定时,达到滴定终点的现象是___________________________________________。Na2S2O3·5H2O在产品中的质量分数是_______________(用百分数表示,且保留1位小数)。
【答案】 检查装置的气密性 安全瓶(或防止倒吸) B 2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2 过滤、蒸馏水洗涤沉淀,再向沉淀中加入足量的稀盐酸 水中溶解的氧气 淀粉 当加入最后一滴碘水时,溶液无色变蓝色,并且半分钟内不褪色 99.2%
【解析】试题分析:(1).涉及气体的实验,要先验证装置气密性;SO2易溶于水,实验中要防止倒吸;SO2是酸性氧化物,能与碱性溶液反应;(2)C中SO2与Na2CO3和Na2S反应生成Na2S2O3和CO2;Ⅲ.(1)根据Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl分析;(2)蒸馏水经过煮沸可以除去水中溶解的氧气;用碘液进行滴定,所以用淀粉作指示剂;当加入最后一滴碘水时,溶液无色变蓝色,并且半分钟内不褪色时,达到滴定终点。根据方程式2Na2S2O3+I2= Na2S4O6+2NaI进行计算。
解析:(1).涉及气体的实验,要先验证装置气密性,所以组装好装置后,应先检查装置的气密性,再按图示加入试剂;SO2易溶于水,实验中要防止倒吸,B和D的作用是防倒吸;SO2是酸性氧化物,能与碱性溶液反应,所以E中的试剂是氢氧化钠溶液,选B;(2)C中SO2与Na2CO3和Na2S反应生成Na2S2O3和CO2,反应方程式是2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2;Ⅲ.(1)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl,所以取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,过滤、蒸馏水洗涤沉淀,再向沉淀中加入足量的稀盐酸,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4;(2)蒸馏水经过煮沸可以除去水中溶解的氧气;用碘液进行滴定,所以用淀粉作指示剂;当加入最后一滴碘水时,溶液无色变蓝色,并且半分钟内不褪色时,达到滴定终点。设10mL溶液中含Na2S2O3·5H2O xg,第二次实验数值偏离正常值舍去,第一次、第三次实验消耗碘液的平均体积为20mL,

X=0.992g;100mL溶液中含Na2S2O3·5H2O 9.92g,则Na2S2O3·5H2O在产品中的质量分数是![]() 。
。


科目:高中化学 来源: 题型:
【题目】在强酸性溶液中能大量共存的无色透明离子组是( )
A.K+、Na+、NO3-、MnO4-B.Mg2+、Na+、Cl-、SO42-
C.K+、Na+、Cu2+、Cl-D.Ba2+、Na+、OH-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示3套实验装置,分别回答下列问题:


(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入铁钉的玻璃筒内滴入KSCN溶液呈无色,再滴入氯水即可观察到铁钉附近的溶液变红色,表明铁被_______(填氧化、还原);向插入碳棒的玻璃筒内滴入酚酞试液,可观察到碳棒附近的溶液变红,该电极反应为_______________。
(2)装置2中的石墨是_________极(填“正”或“负”),该装置发生的总反应的离子方程式为___________________________________。
(3)装置3中甲烧杯盛放100 mL 0.2 mol·L-1的NaCl溶液,乙烧杯盛放100 mL 0.5 mol·L-1的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞试液,观察到石墨电极附近首先变红。
①电源的M端为_________极,甲烧杯中铁电极的电极反应为________________;
②乙烧杯中电解反应的离子方程式为___________________________________;
③停止电解,取出Cu电极,洗涤、干燥、称量,电极增重0.64 g,则甲烧杯中产生的气体在标准状况下为____________ mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,将一定量A、B气体混合后发生反应:xA(g)+yB(g)![]() zC(g)+mD(s)。平衡时测得A的浓度为0.5mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.3mol/L。则下列有关判断正确的是 ( )
zC(g)+mD(s)。平衡时测得A的浓度为0.5mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.3mol/L。则下列有关判断正确的是 ( )
A. x+y>z+m B. 混合气体的密度一定减小
C. 平衡向正反应方向移动 D. B的转化率一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前汽车上使用的电瓶大多仍是铅蓄电池,其构造示意图如下。发生反应的化学方程式为:Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(l),下列说法不正确的是
2PbSO4(s)+2H2O(l),下列说法不正确的是
A. 放电时,电解质溶液的pH值增大
B. 放电时,电路中转移0.2mol电子时Pb电极质量减少20.7g
C. 放电时,溶液中H+向PbO2电极移动
D. 放电时,正极反应为:PbO2(s)+4H+(aq)+SO42-(aq)+2e-=PbSO4(s)+2H2O(l)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用石油产品A(C4H8),可以合成材料化学重要的物质G和H。己知:
①A和C的核磁共振氢谱都有2组峰,且峰面积之比分别为1∶3和1∶2
②E和F都可发生银镜反应;E的分子式为:C4H4O2
③H2C=CH2+H2O2![]()
![]()
④R-CH2-CHO+HCHO![]()
![]()
G和H的合成路线如下图所示:
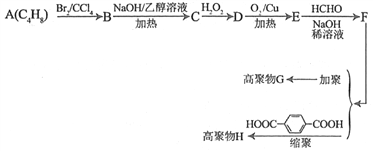
请回答下列问题:
(1)C的名称________________;F中官能团名称为____________________。
(2)A的同分异构体共有___________种(不包括A本身,不含立体异构)
(3)写出B到C的化学方程式和反应类型:
化学方程式为______________________________________________,反应类型是___________。
(4)D→E的化学方程式为___________________________________________。
(5)H的结构简式为_______________________________________________,G的结构简式为____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列哪种物质所含的原子数与0.5molH2O所含原子数相等( )
A.0.6molH2O2B.0.5molH2SO4C.1molHNO3D.1.5molHe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列变化进行推断:
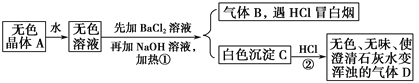
且已知A为正盐。
(1)推断A、B、C、D的化学式:A________,B________,C________,D________。
(2)写出①②变化的离子方程式:①________________,②__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知温度T时水的离子积常数为KW,该温度下,将浓度为amol·L-1的一元酸HA与bmol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )
A. a=b
B. 混合溶液的pH=7
C. 混合溶液中,c(H+)=![]() mol·L-1
mol·L-1
D. 混合溶液中c(H+)+c(B+)=c(OH-)+c(A-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com