
【题目】如图所示3套实验装置,分别回答下列问题:


(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入铁钉的玻璃筒内滴入KSCN溶液呈无色,再滴入氯水即可观察到铁钉附近的溶液变红色,表明铁被_______(填氧化、还原);向插入碳棒的玻璃筒内滴入酚酞试液,可观察到碳棒附近的溶液变红,该电极反应为_______________。
(2)装置2中的石墨是_________极(填“正”或“负”),该装置发生的总反应的离子方程式为___________________________________。
(3)装置3中甲烧杯盛放100 mL 0.2 mol·L-1的NaCl溶液,乙烧杯盛放100 mL 0.5 mol·L-1的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞试液,观察到石墨电极附近首先变红。
①电源的M端为_________极,甲烧杯中铁电极的电极反应为________________;
②乙烧杯中电解反应的离子方程式为___________________________________;
③停止电解,取出Cu电极,洗涤、干燥、称量,电极增重0.64 g,则甲烧杯中产生的气体在标准状况下为____________ mL。
【答案】 氧化 O2+4e-+2H2O==4OH- 正 2Fe3++Cu====2Fe2++Cu2+ 正 Fe-2e-====Fe2+ 2Cu2++2H2O![]() 2Cu+O2↑+4H+ 224
2Cu+O2↑+4H+ 224
【解析】试题分析:(1)铁发生吸氧腐蚀,铁被氧化生成Fe2+,正极发生还原反应,氧气得到电子被还原生成OH-,电极方程式为O2+4e-+2H2O-═4OH-,故答案为:氧化;O2+4e-+2H2O-═4OH-;
(2)形成原电池,Fe失电子作负极,石墨是正极,铜在负极失电子,Fe3+在正极得电子,发生2Fe3++ Cu = 2Fe2++ Cu2+,故答案为:正;2Fe3++ Cu = 2Fe2++ Cu2+;
(3)向甲烧杯中滴入几滴酚酞,观察到右边石墨电极附近首先变红,说明甲中右边电极生成OH-,应为电解池的阴极,则M为电源的正极,N为电源的负极,甲为电解食盐水装置,乙为电解硫酸铜装置,则
①M为电源的正极,甲为电解食盐水装置,甲烧杯中铁电极为阳极,电极反应为Fe - 2e-="=" Fe2+,故答案为:正;Fe - 2e-= Fe2+;
②乙为电解硫酸铜溶液,阳极生成氧气,阴极生成铜,电解的方程式为2Cu2++2H2O![]() 2Cu+O2↑+4H+;
2Cu+O2↑+4H+;
③取出Cu电极,洗涤、干燥、称量、电极增重0.64g,则生成Cu的物质的量为![]() =0.01mol,转移的电子的物质的量为0.01mol×2=0.02mol,
=0.01mol,转移的电子的物质的量为0.01mol×2=0.02mol,
甲烧杯中,阳极铁被氧化,阴极产生气体为氢气,
2H2O+2e-═2OH-+H2↑,
2mol 22.4L
0.02mol V
V=![]() =0.224L=224mL,故答案为:224
=0.224L=224mL,故答案为:224


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】CH4﹣O2燃料电池具有放电稳定,无污染等优点,如图为一用甲烷氧气燃料电池电解饱和氯化钠溶液的模型图。请认真读图,回答以下问题:

(1)请写出通入甲烷气体的一极所发生的电极反应式:____________________,其附近的pH值___(填“不变”或“变大”或“变小”)
(2)如果通入1mol的甲烷完全参与电极反应,则电路中转移_____________的电子,a电极产生的气体在标准状况下的体积为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示与对应叙述不相符的是( )




A. 图甲表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS)>Ksp(CuS)
B. 图乙表示pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸
C. 25℃时,图丙表示用0.100mol·L-1的NaOH溶液滴定25.00mL盐酸的滴定曲线,则c(HCl)=0.080mol·L-1
D. 图丁表示反应N2(g)+3H2(g)![]() 2NH3(g)平衡时NH3体积分数随起始
2NH3(g)平衡时NH3体积分数随起始![]() 变化的曲线,则转化率:aA(H2)<aB(H2)
变化的曲线,则转化率:aA(H2)<aB(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如下图所示,电池总反应为2Ag+Cl2===2AgCl。下列说法正确的是( )

A. 正极反应为AgCl+e-===Ag+Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按下图所示装置进行实验,并回答下列问题:

(1)锌极发生反应的电极反应式为_______________________________;铜极发生反应的电极反应式为_______________________________________________;
(2)石墨棒C1发生反应的电极反应式为____________________________;石墨棒C2附近发生的实验现象为____________________________________________。
(3)当C2极析出224 mL气体(标准状况)时,锌的质量减少_____g,CuSO4溶液的质量________(填“增加”或“减少”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中属于氧化还原反应的是
A. CaO + H2O = Ca(OH)2 B. CaCO3 + 2HCl= CaCl2 + CO2↑+H2O
C. 2H2O2 ![]() 2H2O + O2↑ D. CaCO3
2H2O + O2↑ D. CaCO3![]() CaCO3 + CO3↑
CaCO3 + CO3↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )

A. 反应CH4+H2O![]() 3H2+CO,每消耗1molCH4转移8mol电子
3H2+CO,每消耗1molCH4转移8mol电子
B. 电极A上H2参与的电极反应为:H2+CO32--2e-=H2O+CO2
C. 电池工作时,CO32-向电极B移动
D. 用电器上每通过4mol电子,电极B上参加反应的O2为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
Ⅰ.[查阅资料]
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水。其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合液中通入SO2可制得Na2S2O3,所得产品中常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl。
(4)硫代硫酸钠与碘反应的离子方程式为:2S2O32-+I2=S4O62-+2I-
Ⅱ.[制备产品]实验装置如图所示(省略夹持装置)
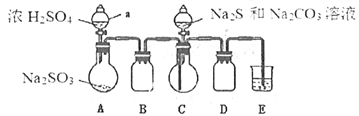
实验步骤:
(1)按如图所示组装好装置后,应先_______________(填操作名称),再按图示加入试剂。仪器B和D的作用是____________________________;E中的试剂是__________(选填下列字母编号)。
A.稀H2SO4 B.NaOH溶液 C.饱和NaHSO3溶液
(2)先向烧瓶C中加入Na2S和Na2CO3混合溶液,再向烧瓶A中滴加浓H2SO4。C中反应生成Na2S2O3和CO2,化学方程式为______________________。
(3)待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合液,滤液经蒸发、结晶、过滤、洗涤、干燥、得到产品。
Ⅲ.[探究与反思]
(1)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择):
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,____________,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(2)用I2的标准溶液测定产品的纯度
取10.0g产品,配制成100mL溶液,配制溶液的蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除__________及二氧化碳。取10.00mL溶液。以________溶液为指示剂,用浓度为0.10mol/LI2的标准溶波进行滴定,相关数据记录如下表所示。
编号 | 1 | 2 | 3 |
溶液的体积/mL | 10.00 | 10.00 | 10.00 |
消耗I2标准溶液的体积/mL | 19.95 | 17.10 | 20.05 |
滴定时,达到滴定终点的现象是___________________________________________。Na2S2O3·5H2O在产品中的质量分数是_______________(用百分数表示,且保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D为气体,其中A呈黄绿色,D极易溶于水,形成的溶液可使酚酞变红。它们之间的转化关系如图所示:

(1)将B点燃,把导管伸入盛满A气体的集气瓶中,可以观察到的实验现象是______。
(2)实验室可用如图所示装置收集D,下列叙述正确的是________。
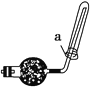
①D气体不能用排水法收集 ②干燥管里盛有碱石灰 ③如图中的a为浸有稀硫酸的棉花
(3)检验E中阳离子的方法是:取少量E于试管中,________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com