
【题目】已知A、B、C、D为气体,其中A呈黄绿色,D极易溶于水,形成的溶液可使酚酞变红。它们之间的转化关系如图所示:

(1)将B点燃,把导管伸入盛满A气体的集气瓶中,可以观察到的实验现象是______。
(2)实验室可用如图所示装置收集D,下列叙述正确的是________。
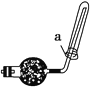
①D气体不能用排水法收集 ②干燥管里盛有碱石灰 ③如图中的a为浸有稀硫酸的棉花
(3)检验E中阳离子的方法是:取少量E于试管中,________________________。
【答案】 安静燃烧,发出苍白色火焰,瓶口有白雾 ①②③ 加入浓NaOH溶液,加热,生成无色有刺激性气味的气体,用湿润的红色石蕊试纸靠近试管口处,若试纸变为蓝色,证明E中有NH4+ (答案合理即可)
【解析】
A为黄绿色气体,应为Cl2,D极易溶于水,形成的溶液可使酚酞变红,应为NH3,则C应为HCl,B为H2,则E为NH4Cl,结合对应物质的性质以及题目要求可解答该题。
根据以上分析可知A为Cl2,B为H2,C为HCl,D为NH3,E为NH4Cl,则
(1)B为H2,在氯气中燃烧时生成HCl,因HCl易溶于水,则可观察到有白雾生成,反应放热,黄绿色褪去,发出苍白色火焰等现象;
(2)氨气易溶于水,具有碱性,与硫酸反应,用硫酸吸收尾气,用碱石灰干燥氨气,氨气密度比空气小,可用向下排空法收集,不能用排水法收集,答案为①②③;
(3)检验铵根离子的方法是加入浓NaOH溶液,加热,生成无色有刺激性气味的气体,用湿润的红色石蕊试纸检验,试纸变为蓝色,证明E中有NH4+。


科目:高中化学 来源: 题型:
【题目】如图所示3套实验装置,分别回答下列问题:


(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入铁钉的玻璃筒内滴入KSCN溶液呈无色,再滴入氯水即可观察到铁钉附近的溶液变红色,表明铁被_______(填氧化、还原);向插入碳棒的玻璃筒内滴入酚酞试液,可观察到碳棒附近的溶液变红,该电极反应为_______________。
(2)装置2中的石墨是_________极(填“正”或“负”),该装置发生的总反应的离子方程式为___________________________________。
(3)装置3中甲烧杯盛放100 mL 0.2 mol·L-1的NaCl溶液,乙烧杯盛放100 mL 0.5 mol·L-1的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞试液,观察到石墨电极附近首先变红。
①电源的M端为_________极,甲烧杯中铁电极的电极反应为________________;
②乙烧杯中电解反应的离子方程式为___________________________________;
③停止电解,取出Cu电极,洗涤、干燥、称量,电极增重0.64 g,则甲烧杯中产生的气体在标准状况下为____________ mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列哪种物质所含的原子数与0.5molH2O所含原子数相等( )
A.0.6molH2O2B.0.5molH2SO4C.1molHNO3D.1.5molHe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列变化进行推断:
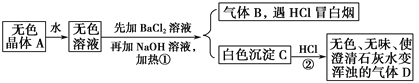
且已知A为正盐。
(1)推断A、B、C、D的化学式:A________,B________,C________,D________。
(2)写出①②变化的离子方程式:①________________,②__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在学习元素化合物知识的过程中,发现含有相同元素的物质间在一定条件下存在转化规律,绘制出如下转化关系图(部分反应物或产物略去),并用于研究物质A、B、C、D的性质及其变化。

(1)若A是黄绿色气体,X是生活中应用最大量的金属,D是白色固体。
① 组成A的元素在周期表中的位置是______。
② 下列说法正确的是______(填字母)。
a.C只具有还原性
b.B的水溶液中加入KSCN溶液,变为红色
c.若Y是碱,D放置在空气中会迅速变为灰绿色,最终变为红褐色
(2)若A、B、C、D的焰色反应均为黄色,X的固体俗称干冰。
① B转化为C的化学方程式是______。
② A用于呼吸面具或潜水艇中氧气的来源,则A和X反应生成1 mol B时,转移电子的物质的量为______ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.反应条件是加热的反应都是吸热反应
B.化学反应除了生成新的物质外,还伴随着能量的变化
C.物质燃烧不一定是放热反应
D.放热的化学反应不需要加热就能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84”消毒液在日常生活中使用广泛,该消毒液无色,有漂白作用。它的有效成份是下列物质中的一种,这种物质是
A.KMnO4B.Na2O2C.NH3·H2OD.NaClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知温度T时水的离子积常数为KW,该温度下,将浓度为amol·L-1的一元酸HA与bmol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )
A. a=b
B. 混合溶液的pH=7
C. 混合溶液中,c(H+)=![]() mol·L-1
mol·L-1
D. 混合溶液中c(H+)+c(B+)=c(OH-)+c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、CO2是火力发电厂释放出的主要尾气,它们虽会对环境造成负面影响,但也是重要的化工原料,其回收利用是环保领域研究的热点课题。
(1)CO 与Cl2在催化剂的作用下合成光气(COCl2)。某温度下,向2L 的密闭容器中投入一定量的CO与Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)![]() COCl2(g) ΔH=a kJ/ mol。
COCl2(g) ΔH=a kJ/ mol。
反应过程中测定的部分数据如下表:
t/ min | n (CO) /mol | n (Cl2) /mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
①反应从开始到2min 末这一段时间内的平均速率v(COCl2)=_____mol/(L·min)。
②在2min~4min 间,v (Cl2) 正______v (Cl2)逆(填“>”、“<”或“=”),该温度下K=_______。
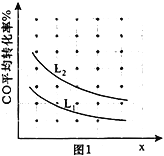
③已知X、L可分别代表温度或压强,图1表示L不同时,CO的转化率随X的变化关系。L代表的物理量是_____________;a_________0(填“>”、“<”或“=”)。
(2)在催化剂作用下NO和CO 可转化为无毒气体:
2CO(g)+2NO(g)![]() 2CO2(g)+N2(g) △H
2CO2(g)+N2(g) △H
①已知: N2(g)+O2 (g)=2NO(g) △H1= +180.0kJ/mol
2C(s)+O2 (g)=2CO (g) △H2= -221.0 kJ/mol
2C(s)+2O2 (g)=2CO2 (g) △H3= -787.0 kJ/mol
则ΔH=____________。
②研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。某同学设计了三组实验(实验条件已经填在下面的实验设计表中)。实验的设计目的是___________________________。
实验编号 | T(℃) | NO初始浓度 (mol L-1) | CO初始浓度 (mol L-1) | 催化剂的比表面积(m2 g-1) |
Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
Ⅱ | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | 124 |
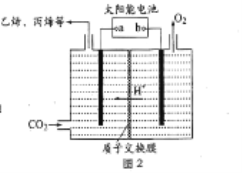
(3)在强酸性的电解质水溶液中,惰性材料作电极,电解CO2可得到多种燃料,其原理如图2 所示。
①b 为电源的_______(填“正”或“负”)极,电解时,生成丙烯的电极反应式是_________。
②侯氏制碱法中可利用CO2、NH3、NaCl等为原料先制得NaHCO3,进而生产出纯碱。已知H2CO3 的Ka1=4.3×10-7 molL-1、Ka2=5.6×10-11 molL-1,NaHCO3溶液中各离子浓度由大到小的顺序为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com