
【题目】CO、CO2是火力发电厂释放出的主要尾气,它们虽会对环境造成负面影响,但也是重要的化工原料,其回收利用是环保领域研究的热点课题。
(1)CO 与Cl2在催化剂的作用下合成光气(COCl2)。某温度下,向2L 的密闭容器中投入一定量的CO与Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)![]() COCl2(g) ΔH=a kJ/ mol。
COCl2(g) ΔH=a kJ/ mol。
反应过程中测定的部分数据如下表:
t/ min | n (CO) /mol | n (Cl2) /mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
①反应从开始到2min 末这一段时间内的平均速率v(COCl2)=_____mol/(L·min)。
②在2min~4min 间,v (Cl2) 正______v (Cl2)逆(填“>”、“<”或“=”),该温度下K=_______。
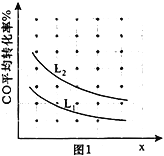
③已知X、L可分别代表温度或压强,图1表示L不同时,CO的转化率随X的变化关系。L代表的物理量是_____________;a_________0(填“>”、“<”或“=”)。
(2)在催化剂作用下NO和CO 可转化为无毒气体:
2CO(g)+2NO(g)![]() 2CO2(g)+N2(g) △H
2CO2(g)+N2(g) △H
①已知: N2(g)+O2 (g)=2NO(g) △H1= +180.0kJ/mol
2C(s)+O2 (g)=2CO (g) △H2= -221.0 kJ/mol
2C(s)+2O2 (g)=2CO2 (g) △H3= -787.0 kJ/mol
则ΔH=____________。
②研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。某同学设计了三组实验(实验条件已经填在下面的实验设计表中)。实验的设计目的是___________________________。
实验编号 | T(℃) | NO初始浓度 (mol L-1) | CO初始浓度 (mol L-1) | 催化剂的比表面积(m2 g-1) |
Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
Ⅱ | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | 124 |
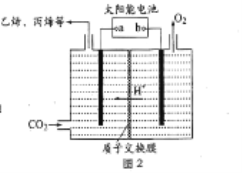
(3)在强酸性的电解质水溶液中,惰性材料作电极,电解CO2可得到多种燃料,其原理如图2 所示。
①b 为电源的_______(填“正”或“负”)极,电解时,生成丙烯的电极反应式是_________。
②侯氏制碱法中可利用CO2、NH3、NaCl等为原料先制得NaHCO3,进而生产出纯碱。已知H2CO3 的Ka1=4.3×10-7 molL-1、Ka2=5.6×10-11 molL-1,NaHCO3溶液中各离子浓度由大到小的顺序为________。
【答案】 0.1 = 5 压强 < ΔH=-746kJ·mol-1 探究温度和催化剂比表面积对化学反应速率的影响 正 3CO2+18H++18e-=C3H6+6H2O c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
【解析】(1)①由表中数据,可知0~2min内△n(CO)=1.2mol-0.8mol=0.4mol,由方程式可知△c(COCl2)=△c(CO)=0.4mol,则v(COCl2)= 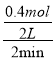 =0.1mol/(L·min),故答案为:0.1;
=0.1mol/(L·min),故答案为:0.1;
②4min内,反应的氯气为0.6mol-0.2mol=0.4mol,由方程式可知参加反应的CO为0.4mol,故4min时CO为1.2mol-0.4mol=0.8mol,与2min时CO的物质的量相等,则2min、4min处于平衡状态,在2min~4min间,v(Cl2)正 =v(Cl2)逆,由方程式可知,平衡时生成COCl2为0.4mol,该温度下平衡常数K=![]() =
= =5,故答案为:=;5;
=5,故答案为:=;5;
③图中随X增大时,CO的平衡转化率降低,平衡逆向移动,则X为温度,正反应为放热反应,a<0,正反应为气体体积减小的反应,随着增大压强平衡正向移动,CO转化率增大,故L为压强,且L1<L2,故答案为:压强;<;
(2)①已知:i.N2(g)+O2(g)=2NO(g) △H1= +180.0kJ/mol,ii.2C(s)+O2(g)=2CO(g) △H2= -221.0 kJ/mol,iii.2C(s)+2O2(g)=2CO2(g) △H3= -787.0 kJ/mol,根据盖斯定律,将iii-i-ii得2CO(g)+2NO(g)![]() 2CO2(g)+N2(g) △H=(-787.0 kJ/mol)-(+180.0kJ/mol)-(-221.0 kJ/mol)=-746kJ·mol-1,故答案为:-746kJ·mol-1;
2CO2(g)+N2(g) △H=(-787.0 kJ/mol)-(+180.0kJ/mol)-(-221.0 kJ/mol)=-746kJ·mol-1,故答案为:-746kJ·mol-1;
②利用控制变量法分析解答,Ⅰ、Ⅱ研究的是催化剂的比表面积对速率的影响,Ⅱ、Ⅲ的催化剂比表面积相同,研究的是温度对速率的影响,Ⅰ、Ⅲ催化剂的比表面积不同,温度不同,研究温度、催化剂的比表面积对反应速率的影响,故目的是:探究温度、催化剂比表面积对化学反应速率的影响规律,故答案为:探究温度和催化剂比表面积对化学反应速率的影响;
(3)①太阳能电池为电源,电解强酸性的二氧化碳水溶液得到丙烯,电解时,连接电源b极的电极上放出氧气,是溶液中的氢氧根离子失去电子发生了氧化反应的结果,因此b为电源的正极,二氧化碳在a极上生成乙烯、丙烯等,得到电子发生还原反应,电极反应式为3CO2+18H++18e-=C3H6+6H2O,故答案为:正;3CO2+18H++18e-=C3H6+6H2O;
②NaHCO3溶液的水解常数Kh=![]() =
=![]() =
=![]() ×10-7>Ka2=5.6×10-11,说明水解程度大于电离程度,溶液显碱性,氢离子有碳酸氢根离子电离和水的电离得到,则c(H+)>c(CO32-),因此NaHCO3溶液中各离子浓度由大到小c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-),故答案为:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)。
×10-7>Ka2=5.6×10-11,说明水解程度大于电离程度,溶液显碱性,氢离子有碳酸氢根离子电离和水的电离得到,则c(H+)>c(CO32-),因此NaHCO3溶液中各离子浓度由大到小c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-),故答案为:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)。


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】已知A、B、C、D为气体,其中A呈黄绿色,D极易溶于水,形成的溶液可使酚酞变红。它们之间的转化关系如图所示:

(1)将B点燃,把导管伸入盛满A气体的集气瓶中,可以观察到的实验现象是______。
(2)实验室可用如图所示装置收集D,下列叙述正确的是________。
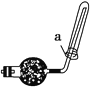
①D气体不能用排水法收集 ②干燥管里盛有碱石灰 ③如图中的a为浸有稀硫酸的棉花
(3)检验E中阳离子的方法是:取少量E于试管中,________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列顺序,其中错误的是( )
A.氢化物稳定性增强:HF、H2O、NH3B.酸性减弱:HClO4、HBrO4、HIO4
C.还原性增强:A1、Mg、NaD.非金属性减弱:Cl、S、P
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质间的反应不能通过一步反应实现的是( )
A.Na2CO3→NaClB.NaCl→ NaOH
C.NaOH→NaClD.CuO→Cu(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关丙烯(CH3CH=CH2)的结构或性质叙述中不正确的是
A. 分子中所有碳原子都在同一平面上
B. 能使溴水褪色
C. 能使酸性高锰酸钾溶液褪色
D. 与氯化氢发生加成反应只能生成一种产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、M为短周期主族元素,25°C时,其最高价氧化物对应的水化物(浓度均为 0.01mol.L-1)溶液的pH和原子半径的关系如图所示。下列有关说法不正确的是
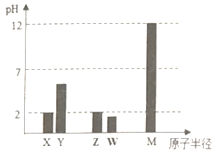
A. Y的最高价氧化物的电子式为:![]()
B. 最简单气态氢化物的热稳定性:Z>W
C. X、M两种元素形成的简单离子半径大小顺序:X<M
D. X的氢化物与Z的氢化物反应后生成的化合物中既含离子键又含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如下。下列说法不正确的是
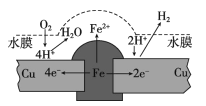
A. 腐蚀过程中铜极上始终只发生: 2H++2e-= H2↑
B. 若水膜中溶有食盐将加快铁铆钉的腐蚀
C. 若在金属表面涂一层油脂能防止铁铆钉被腐蚀
D. 若将该铜板与直流负极相连,则铁铜均难被腐蚀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com