
| A. | 单质均能与水反应生成HXO | |
| B. | 从上到下,HX的氧化性增强,对应水溶液酸性增强 | |
| C. | 从上到下,卤素原子的电子层数依次增多,原子半径依次增大 | |
| D. | 卤素均能形成最高价含氧酸,其分子通式为HXO4 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 杜绝污染源 | B. | 治理污染点 | C. | 处理废弃物 | D. | 减少有毒物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl、Ag2C2O4、AgI三者的饱和溶液中c(Ag+)大小顺序:Ag2C2O4>AgCl>AgI | |
| B. | 将0.02mol•L-1AgNO3溶液和0.02mol•L-1Na2SO4溶液等体积混合,有沉淀生成 | |
| C. | 向5mL饱和溶液AgCl溶液中滴加0.5mL0.1mol•L-1KI溶液,无沉淀生成 | |
| D. | 向浓度均为0.1mol•L-1的NaCl和KI混合溶液中滴加AgNO3溶液,先有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M的气态氢化物比N的气态氢化物稳定 | |
| B. | X、Y的简单离子半径:r(X2-)>r(Y+) | |
| C. | M与X形成的化合物对应的水化物一定是强酸 | |
| D. | Y2X和Y2X2中阴、阳离子的个数比相同,化学键类型也完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 已知X、Y、Z三元素的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10.C、D是由X、Y、Z中两种元素组成的化合物,C通常状况下为无色液体,D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷电路板.各物质之间的转换关系如图,部分生成物省略.
已知X、Y、Z三元素的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10.C、D是由X、Y、Z中两种元素组成的化合物,C通常状况下为无色液体,D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷电路板.各物质之间的转换关系如图,部分生成物省略.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
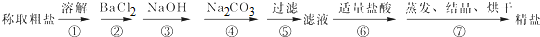
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一支钢笔使用不同品牌墨水时,容易发生堵塞现象 | |
| B. | 当日光从窗隙射入暗室时,可观察到一束光线 | |
| C. | 向氢氧化铁与水形成的某分散系中插入正、负电极,通直流电一段时间后,一极附近颜色变深 | |
| D. | 向氯化铁溶液中加入氢氧化钠溶液,产生红褐色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com