
【题目】为了除去KCl固体中少量的MgCl2、MgSO4,可选用Ba(OH)2、盐酸和K2CO3三种 试剂,按如下步骤操作:
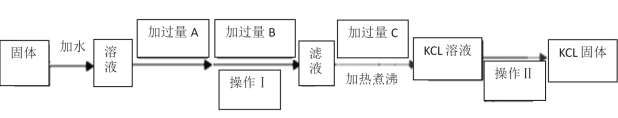
(1)图中三种试剂分别为:A__________________、 B__________________、 C___________________。
(2)加入过量A的目的是______________________________________________________________________;
加入过量B的目的是______________________________________________________________________;
加热煮沸的目的是______________________________________________________________________;
(3)操作Ⅱ的名称是______________________________。
(4)检验得到的KCl中不含有SO42-的操作________________________________________
【答案】Ba(OH)2K2CO3盐酸除尽Mg2+和SO42-除尽过量的Ba2+使过量的HCl挥发蒸发取KCl固体少许于试管中,滴加蒸馏水溶解,先滴加稀盐酸再滴加氯化钡溶液,若不产生白色沉淀,则证明不含有硫酸根离子
【解析】
为了除去MgCl2、MgSO4应加入过量的Ba(OH)2,充分反应后生成Mg(OH)2沉淀和BaSO4沉淀,KCl中仍含有BaCl2和过量的Ba(OH)2,再向体系中加入过量的K2CO3除去BaCl2和过量的Ba(OH)2,充分反应后过滤,所得滤液中含有KCl、KOH和过量的K2CO3;最后向滤液中加入过量的盐酸除去KOH和过量的K2CO3,由于盐酸具有挥发性,将溶液加热煮沸使过量的HCl挥发获得KCl溶液,将KCl溶液蒸发获得KCl固体。根据以上分析回答(1)~(3)。用稀盐酸和BaCl2溶液检验SO42-。
为了除去MgCl2、MgSO4应加入过量的Ba(OH)2,充分反应后生成Mg(OH)2沉淀和BaSO4沉淀,KCl中仍含有BaCl2和过量的Ba(OH)2,再向体系中加入过量的K2CO3除去BaCl2和过量的Ba(OH)2,充分反应后过滤,所得滤液中含有KCl、KOH和过量的K2CO3;最后向滤液中加入过量的盐酸除去KOH和过量的K2CO3,由于盐酸具有挥发性,将溶液加热煮沸使过量的HCl挥发获得KCl溶液,将KCl溶液蒸发获得KCl固体。
(1)根据上述分析,图中三种试剂,A为Ba(OH)2,B为K2CO3,C为盐酸。
(2)加入过量A的目的是除尽Mg2+和SO42-,加入A发生的反应为MgCl2+Ba(OH)2=Mg(OH)2↓+BaCl2、MgSO4+Ba(OH)2=Mg(OH)2↓+BaSO4↓。加入过量B的目的是除尽过量的Ba2+,发生的反应为BaCl2+K2CO3=BaCO3↓+2KCl、Ba(OH)2+K2CO3=BaCO3↓+2KOH。向滤液中加入过量的盐酸除去KOH和过量的K2CO3,由于盐酸具有挥发性,加热煮沸的目的是使过量的HCl挥发。
(3)从KCl溶液中获得KCl固体的操作为蒸发,操作II的名称是蒸发。
(4)用稀盐酸和BaCl2溶液检验SO42-。检验得到的KCl中不含SO42-的操作:取KCl固体少许于试管中,滴加蒸馏水溶解,先滴加稀盐酸再滴加氯化钡溶液,若不产生白色沉淀,则证明不含有SO42-。


科目:高中化学 来源: 题型:
【题目】2008年北京奥运会的“祥云”火炬所用燃料的主要成分是丙烷,下列有关丙烷的叙述中不正确的是( )
A.分子中碳原子不在一条直线上
B.光照下能够发生取代反应
C.比丁烷更易液化
D.是石油分馏的一种产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】甲醇水蒸气重整制氢(SRM)是用于驱动电动汽车的质子交换膜燃料电池的理想氢源,当 前研究主要集中在提高催化剂活性和降低尾气中CO含量,以免使燃料电池Pt电极中毒。重整过程发生的反应如下:
反应I CH3OH(g)+H2O(g) ![]() CO2(g)+3H2(g) ΔH1
CO2(g)+3H2(g) ΔH1
反应Ⅱ CH3OH(g) ![]() CO(g)+2H2(g) ΔH2
CO(g)+2H2(g) ΔH2
反应Ⅲ.CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
其对应的平衡常数分别为K1、K2、K3,其中K2、K3随温度变化如下表所示:
125℃ | 225℃ | 325℃ | |
K2 | 0.5535 | 185.8 | 9939.5 |
K3 | 1577 | 137.5 | 28.14 |
请回答:
(1)反应Ⅱ能够自发进行的条件_______ (填 “低温”、“高温”或“任何温度”), ΔH1____ΔH3 (填 “>”、“<”或 “=” )。
(2)相同条件下,甲醇水蒸气重整制氢较甲醇直接分解制氢(反应Ⅱ)的先进之处在于_________。
(3)在常压、CaO催化下,CH3OH和H2O混和气体(体积比1∶1.2,总物质的量2.2mol)进行反应,tl时刻测得 CH3OH转化率及CO、CO2选择性随温度变化情况分别如图所示(CO、CO2的选择性:转化的CH3OH中生成CO、CO2的百分比)。
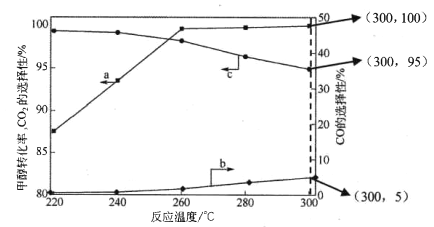
注:曲线a表示CH3OH的转化率,曲线b表示CO的选择性,曲线c表示 CO2的选择性
① 下列说法不正确的是_____。
A.反应适宜温度为300℃
B.工业生产通 常在负压条件下进行甲醇水蒸气重整
C.己知 CaO催化剂具有更高催化活性,可提高甲醇平衡转化率
D.添加CaO的复合催化剂可提高氢气产率
② 260℃ 时H2物质的量随时间的变化曲线如图所示。画出300℃时至t1时刻H2物质的量随时间的变化曲线_____。
(4)副产物CO2可以在酸性水溶液中电解生成甲酸,生成甲酸的电极反应式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】某研究小组按下列路线合成某药物X(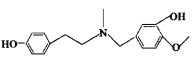 ):
):
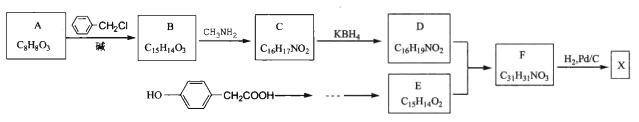
已知: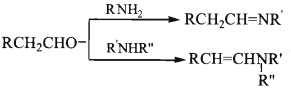
![]()
![]()
请回答:
(1)下列说法不正确的是_______。
A.化合物A能发生银镜反应
B.化合物B能与 FeCl3发生显色反应
C.化合物X的分子式为 C17H21NO3
D.化合物F含有两种含氧官能团
(2)化合物D的 结构简式是_________。
(3)写出 B→C的化学方程式______________。
(4)利用题中有关信息及物质,设计 以![]() 为原料制备E的合成路线(用流程图表示,无 机试剂任选) _____________________。
为原料制备E的合成路线(用流程图表示,无 机试剂任选) _____________________。
(5)写出同时符合下列条件的C的所有同分异构体的结构简式_____________。
① 分子中含有两个苯环,且苯环上都只有对位取代基;
② IR谱显示存在-CONH-和![]() 结构,lH-NMR谱显示分子中有7种氢原子。
结构,lH-NMR谱显示分子中有7种氢原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选择性催化还原法(SCR)烟气脱硝技术是一种成熟的NOx控制处理方法,主要反应如下:
①4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) △H1=akJ·mol-1
4N2(g)+6H2O(g) △H1=akJ·mol-1
②4NH3(g)+2NO2(g)+O2(g)![]() 3N2(g)+6H2O(g) △H2=bkJ·mol-1
3N2(g)+6H2O(g) △H2=bkJ·mol-1
副反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H4=dkJ·mol-1
4NO(g)+6H2O(g) △H4=dkJ·mol-1
可以计算出反应2NO(g)+O2(g)![]() 2NO2(g)的△H为( )
2NO2(g)的△H为( )
A. (4b-3a+d)/4 B. (4a-3b+d)/4 C. (3b-4a+d)/4 D. (3a-4b+d)/4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】宋代著名法医学家宋慈 的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理是4Ag+2H2S+O2═2Ag2S+2H2O,其中H2S是( )
A.氧化剂
B.还原剂
C.既是氧化剂又是还原剂
D.既不是氧化剂又不是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在火箭推进器中装有还原剂肼(N2H4)和强氧化剂H2O2,当它们混合时,即产生大量的的氮气和水蒸气,并放出大量的热量.已知0.4mol液态肼和足量双氧水反应生成氮气和水蒸气时放出256.65KJ的热量。
(1)写出肼和过氧化氢的结构式肼_______,过氧化氢_________。
(2)上述反应应用于火箭推进剂,除释放出大量热量和快速产生大量气体外,还有一个很突出的优点是______。
(3)写出肼和双氧水反应的热化学方程式___________。
(4)已知H2O(l)═H2O(g);△H=+44KJ/mol,则16g液态肼与足量双氧水反应生成氮气和液态水时,放出的热量是_________。
(5)已知:
N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-543kJ/mol
则肼与NO2完全反应的热化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式中,不正确的是( )
A.HCl═H++Cl﹣
B.NH3H2O═NH4++OH﹣
C.CaCl2=Ca2++2Cl﹣
D.CH3COOHCH3COO﹣+H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com