
【题目】【加试题】甲醇水蒸气重整制氢(SRM)是用于驱动电动汽车的质子交换膜燃料电池的理想氢源,当 前研究主要集中在提高催化剂活性和降低尾气中CO含量,以免使燃料电池Pt电极中毒。重整过程发生的反应如下:
反应I CH3OH(g)+H2O(g) ![]() CO2(g)+3H2(g) ΔH1
CO2(g)+3H2(g) ΔH1
反应Ⅱ CH3OH(g) ![]() CO(g)+2H2(g) ΔH2
CO(g)+2H2(g) ΔH2
反应Ⅲ.CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
其对应的平衡常数分别为K1、K2、K3,其中K2、K3随温度变化如下表所示:
125℃ | 225℃ | 325℃ | |
K2 | 0.5535 | 185.8 | 9939.5 |
K3 | 1577 | 137.5 | 28.14 |
请回答:
(1)反应Ⅱ能够自发进行的条件_______ (填 “低温”、“高温”或“任何温度”), ΔH1____ΔH3 (填 “>”、“<”或 “=” )。
(2)相同条件下,甲醇水蒸气重整制氢较甲醇直接分解制氢(反应Ⅱ)的先进之处在于_________。
(3)在常压、CaO催化下,CH3OH和H2O混和气体(体积比1∶1.2,总物质的量2.2mol)进行反应,tl时刻测得 CH3OH转化率及CO、CO2选择性随温度变化情况分别如图所示(CO、CO2的选择性:转化的CH3OH中生成CO、CO2的百分比)。
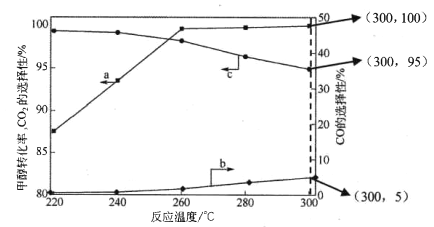
注:曲线a表示CH3OH的转化率,曲线b表示CO的选择性,曲线c表示 CO2的选择性
① 下列说法不正确的是_____。
A.反应适宜温度为300℃
B.工业生产通 常在负压条件下进行甲醇水蒸气重整
C.己知 CaO催化剂具有更高催化活性,可提高甲醇平衡转化率
D.添加CaO的复合催化剂可提高氢气产率
② 260℃ 时H2物质的量随时间的变化曲线如图所示。画出300℃时至t1时刻H2物质的量随时间的变化曲线_____。
(4)副产物CO2可以在酸性水溶液中电解生成甲酸,生成甲酸的电极反应式是_________。
【答案】 高温 > 甲醇转化率高;产物中氢气含量高,一氧化碳含量低 ABC 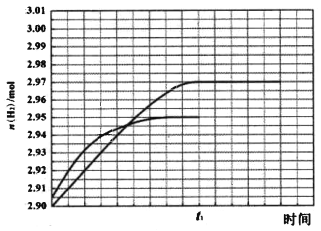 CO2+2H++2e-=HCOOH
CO2+2H++2e-=HCOOH
【解析】(1)由表中数据可得,随温度升高,K2增大,即反应Ⅱ向右移动,说明反应Ⅱ是吸热反应,ΔH2>0,由反应方程式可得ΔS2>0,已知反应能够自发进行的条件是ΔH2-TΔS2<0,推知反应Ⅱ需要在高温下才能自发进行;由于K3随温度升高而减小,即反应Ⅲ向左移动,说明反应Ⅲ是放热反应,ΔH3<0,根据盖斯定律,ΔH1=ΔH2+ΔH3>ΔH3,
(2)由反应I和反应Ⅱ的方程式比较可知,反应物甲醇转化率高,产物中氢气含量高,且几乎没有CO;
(3)①A、由图象可知CH3OH的转化率在高于260℃时较高,但在300℃时,CO的选择性最高,而CO2的选择性最低,所以300℃不是反应适宜的温度,最好在260℃时,故A不正确;B、根据反应方程式可知,减小压强会降低反应速率,不适合工业生产,所以B不正确;C、催化剂能够加快反应速率,但不能改变反应物的转化率,所以C不正确;D、催化剂能加快反应速率,提高单位时间内生成氢气的量,即提高了氢气的产率,即D正确;因此本题正确答案选ABC;②根据甲醇的转化率、CO和CO2选择性图象可知,温度从260℃升高到300℃,反应速率加快,但CO2的选择性减小,使H2的物质的量也减小,所以曲线斜率增大,但水平线低于260℃时的,具体为:反应I 中生成n(H2)= 3n(CO2)=0.95×1mol×3= 2.85mol,反应Ⅱ中生成n(H2)=2n(CO)=0.05×1mol×2=0.10mol,所以生成H2的总物质的量为2.95mol,则画出图象如图所示,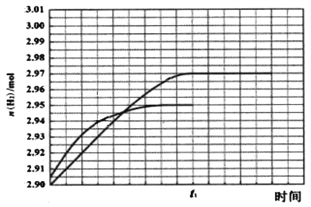 ;
;
(4)CO2在酸性溶液中生成甲酸(HCOOH)时,C元素的化合价是降低,得到电子,将在负极发生反应,反应式为CO2+2H++2e-=HCOOH,


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】(1)下列物质是电解质的有___________,是非电解质的有_______,在本题指定状态下能导电的有_________。(以上各空均填序号)
①CO2、②液态HCl、③稀硝酸、④Al2(SO4)3晶体、⑤NH3、⑥熔融KOH、⑦单质铁。
(2)在标准状况下,测得1.32 g某气体的体积为0.672 L。则此气体的摩尔质量为____________。等质量CO、CO2两种气体的的摩尔质量之比为_______________;同温同压下的体积比为______________。
(3)用于分离或提纯物质的常见方法有:A蒸馏(分馏) B萃取 C过滤 D分液。
下列各组混合物的分离或提纯应选用上述哪一种方法最合适?(填方法的标号)
①除去Ca(OH)2溶液中悬浮的CaCO3微粒_______。
②分离四氯化碳与水的混合物_______。
③分离汽油和煤油_______。
④提取碘水中的碘单质_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下用0.1000mol/L的盐酸分别逐滴加入到20.00mL0.1000 mo1/L的三种一元碱MOH、XOH、YOH溶液中,溶液的pH随加入盐酸体积的变化如图所示。 下列说法不正确的是
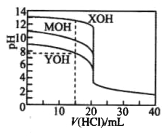
A. XOH为强碱,MOH、YOH均 为弱碱
B. V(HCl)=15.00mL时,三份溶液中离子总浓度大小顺序: XOH>MOH>YOH
C. 当盐酸滴加至20.00 mL时,三条曲线刚好相交
D. 在逐滴加入盐酸至40.00mL的过程中,三份溶液中水的电离程度均先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中的c(Cl﹣)与50mL1molL﹣1 氯化铝溶液中的c(Cl﹣)相等的是( )
A.150mL1molL﹣1氯化钠溶液
B.75mL2molL﹣1氯化铵溶液
C.150mL3molL﹣1氯化钾溶液
D.75mL2molL﹣1氯化钡溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示。下列判断正确的是

A. a、c两点溶液的导电能力相同
B. a、b、c三点溶液中水的电离程度:a>b>c
C. b点溶液中:c(H+)+c(NH3·H2O)=c(OH—)
D. 用等浓度NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液体积Vb=Vc
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去KCl固体中少量的MgCl2、MgSO4,可选用Ba(OH)2、盐酸和K2CO3三种 试剂,按如下步骤操作:
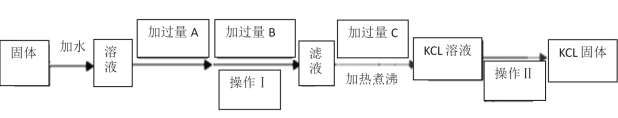
(1)图中三种试剂分别为:A__________________、 B__________________、 C___________________。
(2)加入过量A的目的是______________________________________________________________________;
加入过量B的目的是______________________________________________________________________;
加热煮沸的目的是______________________________________________________________________;
(3)操作Ⅱ的名称是______________________________。
(4)检验得到的KCl中不含有SO42-的操作________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 按系统命名法![]() 的名称为2—甲基—3,5—二乙基己烷
的名称为2—甲基—3,5—二乙基己烷
B. 分子![]() 结构中,最多有7个碳原子共线
结构中,最多有7个碳原子共线
C. 分子式为C4H10O能与金属钠反应并能发生催化氧化的有机物有4种(不含立体异构)
D. 全降解塑料(![]() )可由单体环氧丙烷(
)可由单体环氧丙烷(![]() )和CO2加聚制得
)和CO2加聚制得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性甲醛燃料电池为电源进行电解的实验装置如图所示,下列说法中正确的是

A. 当a、b都是铜作电极时,电解的总反应方程式为2CuSO4+2H2O![]() 2H2SO4+2Cu+O2↑
2H2SO4+2Cu+O2↑
B. 燃料电池工作时,正极反应为O2+2H2O+4e-===4OH-
C. 当燃料电池消耗22.4 L甲醛气体时,电路中理论上转移2 mol e-
D. 燃料电池工作时,负极反应为HCHO+H2O-2e-===HCOOH+2H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com