
【题目】某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示。下列判断正确的是

A. a、c两点溶液的导电能力相同
B. a、b、c三点溶液中水的电离程度:a>b>c
C. b点溶液中:c(H+)+c(NH3·H2O)=c(OH—)
D. 用等浓度NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液体积Vb=Vc
【答案】B
【解析】试题分析:氯化氢为强电解质,溶于水全部电离,溶液中的氢离子主要是盐酸电离出来的;氯化铵为强酸弱碱盐,氢离子来自铵离子的水解,水解是微弱的,pH相同的盐酸和氯化铵溶液,氯化铵的浓度远大于盐酸的浓度;体积和pH都相同的盐酸和氯化铵溶液加水稀释的过程中,盐酸不能继续电离,盐酸中氢离子浓度变化大;氯化铵溶液中铵离子的水解平衡正向移动,溶液中氢离子浓度变化小,所以含c点的曲线pH变化是盐酸的,含a、b点的曲线pH变化是氯化铵溶液的。A、溶液的导电能力取决于溶液中自由移动离子的浓度,起始氯化铵的浓度远大于盐酸的浓度,稀释相同的倍数还是氯化铵的浓度远大于盐酸的浓度,故导电能力:a点大于c点,A错误;B、盐酸电离出的氢离子浓度抑制水的电离,所以c点溶液中水的电离程度最小;水解促进水的电离,由于氯化铵溶液中的氢离子浓度来自于铵根离子水解生成的氢离子,氢离子浓度越大,说明水解程度越大,水的电离程度越大,a点的pH<b点的pH,说明a点氢离子大于b点氢离子,a、b二点溶液水的电离程度:a>b,综上所述a、b、c三点溶液水的电离程度a>b>c,B正确;C、根据质子守恒知,b点溶液中c(OH-)+c(NH3H2O)=c(H+),C错误;D、用等浓度NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液体积Vb>Vc,D错误。答案选B。


科目:高中化学 来源: 题型:
【题目】将二氧化碳转化为燃料是目前的研究热点,2017年《科学》杂志报道的一种将CO2转化为烃和醇的装置如图所示。下列说法正确的是

A. 图中能量转化的方式只有1种
B. 装置工作时,H+向X极区移动,Y极周围溶液的pH增大
C. X极上得到CH3OH的电极反应式为2CO2+4H2O+12e-==2CH3OH+3O2
D. 若X极生成1molC2H4和lmolCH3OH,电路中流过18mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数,下列说法正确的是
A. 2.3g金属钠全部变成钠离子时失去的电子数目为0.2NA
B. 2g氢气所含原子数目为NA
C. 17gNH3 所含的电子数为10NA
D. NA个氧分子和NA个氢分子的质量比等于8 :1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.离子反应和氧化还原反应都是高中化学中重要的反应类型。回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在有______。(填序号)
①单质 ②化合物 ③氧化物 ④酸 ⑤碱 ⑥盐 ⑦电解质
人们常用图示法表示不同反应类型之间的关系,如化合反应和氧化还原反应的关系可用图1表示。图2为离子反应、氧化还原反应和置换反应三者之间的关系,则表示置换反应的是____(填字母),请写出符合图2阴影部分的一个离子方程式______。


图1 图2
Ⅱ.现有失去标签的四瓶无色溶液A,B,C,D,只知它们是K2CO3,K2SO4,Na HSO4和Ba(NO3)2,为鉴别它们,进行如下实验:
①A+D→溶液+气体 ②B+C→溶液+沉淀
③B+D→溶液+沉淀 ④A+B→溶液+沉淀
⑤将④得到的沉淀物加入③所得的溶液中,沉淀很快溶解并产生无色无味的气体。
根据以上实验事实,请完成如下问题:
(3)写出各物质化学式:A__________;B__________;C__________;D__________。
(4)写出实验③中反应中相关的离子方程式。____________________________。
(5)书写离子方程式
①NaHCO3溶液与H2SO4溶液混合:_________________________。
②向石灰水中通入过量二氧化碳________________________________。
③氢氧化亚铁和浓盐酸反应____________________________________。
④醋酸溶液和碳酸镁悬浊液混合生成气体并得到澄清溶液______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】甲醇水蒸气重整制氢(SRM)是用于驱动电动汽车的质子交换膜燃料电池的理想氢源,当 前研究主要集中在提高催化剂活性和降低尾气中CO含量,以免使燃料电池Pt电极中毒。重整过程发生的反应如下:
反应I CH3OH(g)+H2O(g) ![]() CO2(g)+3H2(g) ΔH1
CO2(g)+3H2(g) ΔH1
反应Ⅱ CH3OH(g) ![]() CO(g)+2H2(g) ΔH2
CO(g)+2H2(g) ΔH2
反应Ⅲ.CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
其对应的平衡常数分别为K1、K2、K3,其中K2、K3随温度变化如下表所示:
125℃ | 225℃ | 325℃ | |
K2 | 0.5535 | 185.8 | 9939.5 |
K3 | 1577 | 137.5 | 28.14 |
请回答:
(1)反应Ⅱ能够自发进行的条件_______ (填 “低温”、“高温”或“任何温度”), ΔH1____ΔH3 (填 “>”、“<”或 “=” )。
(2)相同条件下,甲醇水蒸气重整制氢较甲醇直接分解制氢(反应Ⅱ)的先进之处在于_________。
(3)在常压、CaO催化下,CH3OH和H2O混和气体(体积比1∶1.2,总物质的量2.2mol)进行反应,tl时刻测得 CH3OH转化率及CO、CO2选择性随温度变化情况分别如图所示(CO、CO2的选择性:转化的CH3OH中生成CO、CO2的百分比)。
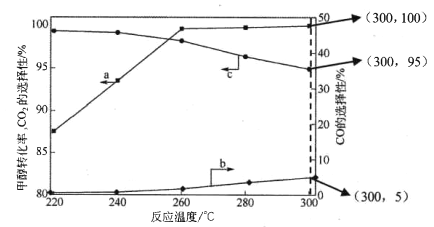
注:曲线a表示CH3OH的转化率,曲线b表示CO的选择性,曲线c表示 CO2的选择性
① 下列说法不正确的是_____。
A.反应适宜温度为300℃
B.工业生产通 常在负压条件下进行甲醇水蒸气重整
C.己知 CaO催化剂具有更高催化活性,可提高甲醇平衡转化率
D.添加CaO的复合催化剂可提高氢气产率
② 260℃ 时H2物质的量随时间的变化曲线如图所示。画出300℃时至t1时刻H2物质的量随时间的变化曲线_____。
(4)副产物CO2可以在酸性水溶液中电解生成甲酸,生成甲酸的电极反应式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】某研究小组按下列路线合成某药物X(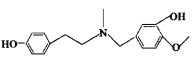 ):
):
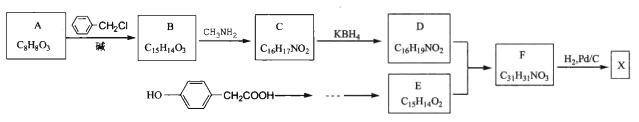
已知: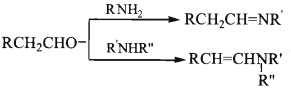
![]()
![]()
请回答:
(1)下列说法不正确的是_______。
A.化合物A能发生银镜反应
B.化合物B能与 FeCl3发生显色反应
C.化合物X的分子式为 C17H21NO3
D.化合物F含有两种含氧官能团
(2)化合物D的 结构简式是_________。
(3)写出 B→C的化学方程式______________。
(4)利用题中有关信息及物质,设计 以![]() 为原料制备E的合成路线(用流程图表示,无 机试剂任选) _____________________。
为原料制备E的合成路线(用流程图表示,无 机试剂任选) _____________________。
(5)写出同时符合下列条件的C的所有同分异构体的结构简式_____________。
① 分子中含有两个苯环,且苯环上都只有对位取代基;
② IR谱显示存在-CONH-和![]() 结构,lH-NMR谱显示分子中有7种氢原子。
结构,lH-NMR谱显示分子中有7种氢原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】宋代著名法医学家宋慈 的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理是4Ag+2H2S+O2═2Ag2S+2H2O,其中H2S是( )
A.氧化剂
B.还原剂
C.既是氧化剂又是还原剂
D.既不是氧化剂又不是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示气体体积均在相同状况下测定)。欲使溶液恢复到起始状态,可向溶液中加入

A. 0.1 mol CuO
B. 0.1 mol CuCO3
C. 0.05 mol Cu2(OH)2CO3
D. 0.1 mol Cu(OH)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com