
【题目】下列有机反应类型判断不正确的是( )
A.HOCH2CH2CH2OH![]()
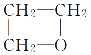 +H2O 消去反应
+H2O 消去反应
B.CH3CH2OH+CuO![]() CH3CHO+Cu+H2O 氧化反应
CH3CHO+Cu+H2O 氧化反应
C.H2C=CHCH=CH2+Cl2![]() CH2ClCH=CHCH2Cl 加成反应
CH2ClCH=CHCH2Cl 加成反应
D.ClCH2CH3+CH3NH2![]() CH3NHCH2CH3+HCl 取代反应
CH3NHCH2CH3+HCl 取代反应
科目:高中化学 来源: 题型:
【题目】进行下面的实验要用到下列一种或几种仪器,请用这些仪器的名称填空。
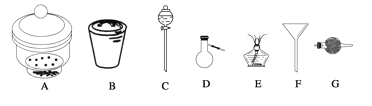
(1)欲干燥NH3需使用仪器_________________________;
(2)欲分离互不相溶的两种液体,可使用____________________________________;
(3)欲分离液态混合物中沸点不同的组分,可使用_____________________________;
(4)欲分离悬浮于液体中的固体物质,可使用_________________________________;
(5)欲用胆矾晶体(CuSO4·5H2O)制无水硫酸铜固体,可使用:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:反应AX3(g)+X2(g)![]() AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
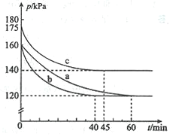
(1)列式计算实验a从反应开始至达到平衡时的反应速率 v(AX5)=________________。
(2)图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为_______________(填实验序号);与实验a相比,其他两组改变的实验条件是:b_________________、c____________________________________。
(3)用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为_________________;实验a和c的平衡转化率:αa为___________、αc为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示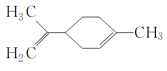 ,下列有关该有机物的说法正确的是( )
,下列有关该有机物的说法正确的是( )
A.该有机物的化学式为C10H14
B.它的一氯代物有6种
C.该有机物分子中所有的碳原子一定在同一平面上
D.一定条件下,它可以发生取代、加成、氧化和还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、L、M、N是元素周期表中前20号的六种元素,它们的原子序数依次增大。X和Y可形成常见化合物YX4,一个YX4分子电子总数为10。L原子的最外层电子数是核外电子总数的3/4。NY2加水生成Y2X2和化合物甲。试回答:
(1)X单质和Z单质在一定条件下可生成化合物乙。
①乙的电子式为________________,化学键类型为________________,晶体类型为________________;
②实验室制取乙的化学方程式为_______________________________________。
(2)由M、Y、L三种元素组成的物质焰色反应显浅紫色,向其溶液中滴入酚酞溶液,溶液显红色,原因是__________________________(用离子方程式表示);若再向溶液中滴入过量的氯化钙溶液,观察到的实验现象是_____________________,原因是____________________________________________________________________。
(3)NY2与水反应生成Y2X2和化合物甲的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由苯乙烯制备乙苯的反应原理为:![]() +H2―→
+H2―→![]() ,下列说法正确的是
,下列说法正确的是
A.苯乙烯和乙苯均能使溴的CCl4溶液褪色
B.乙苯中所有原子可能处于同一平面
C.等质量的苯乙烯和乙苯完全燃烧,苯乙烯消耗O2更多
D.乙苯的一氯代物有5种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下氯化铁为棕黑色固体,易升华。实验室欲证明H2能在加热的条件下还原FeCl3,设计如下实验。下列说法错误的是

A.装置A的优点是随开随用,随关随停
B.导管m的作用是平衡压强,观察是否堵塞
C.装置D中产生白色沉淀即可证明H2能还原FeCl3
D.实验结束后,应先熄灭C处酒精灯,待硬质玻璃管冷却后关闭K
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化六氨合钴(III)([Co(NH3)6]Cl3)是合成其它含钴配合物的重要原料。制备流程如下:
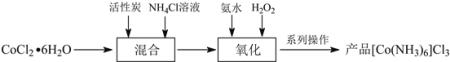
(1) “混合”步骤需在煮沸NH4Cl溶液中加入研细的CoCl2·6H2O晶体,加热煮沸的目的是______。
(2)流程中加入![]() 溶液可防止加氨水时溶液中c(OH)过大,其原理是______。
溶液可防止加氨水时溶液中c(OH)过大,其原理是______。
(3)“氧化”步骤中应先加入氨水再加入![]() ,理由是______。
,理由是______。
(4)为测定产品中钴的含量,进行下列实验:
①称取样品4.000g于烧瓶中,加80mL水溶解,加入15.00mL 4molL-1NaOH溶液,加热至沸15~20min,冷却后加入15.00mL 6molL-1HCl溶液酸化,将![]() 转化成Co3+,一段时间后,将烧瓶中的溶液全部转移至250.00mL容量瓶中,加水定容,取其中25.00 mL试样加入到锥形瓶中;
转化成Co3+,一段时间后,将烧瓶中的溶液全部转移至250.00mL容量瓶中,加水定容,取其中25.00 mL试样加入到锥形瓶中;
②加入足量KI晶体,充分反应;
③![]() 加入淀粉溶液作指示剂,用0.1000molL-1Na2S2O3标准溶液滴定至终点,再重复2 次,测得消耗Na2S2O3溶液的平均体积为15.00mL。(已知:2Co3++2I=2Co2++I2,I2+2S2O32-=2I+S4O62-),通过计算确定该产品中钴的含量(写出计算过程)。______
加入淀粉溶液作指示剂,用0.1000molL-1Na2S2O3标准溶液滴定至终点,再重复2 次,测得消耗Na2S2O3溶液的平均体积为15.00mL。(已知:2Co3++2I=2Co2++I2,I2+2S2O32-=2I+S4O62-),通过计算确定该产品中钴的含量(写出计算过程)。______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,△H1=-393.5 kJmol-1,△H2=-395.4 kJmol-1,下列说法或表示式正确的是( )

A. C(s、石墨)==C(s、金刚石)△H=+1.9kJmol-1
B. 石墨和金刚石的转化是物理变化
C. 金刚石的稳定性强于石墨
D. 1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com