
【题目】进行下面的实验要用到下列一种或几种仪器,请用这些仪器的名称填空。
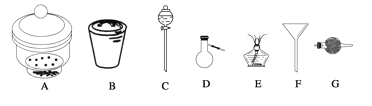
(1)欲干燥NH3需使用仪器_________________________;
(2)欲分离互不相溶的两种液体,可使用____________________________________;
(3)欲分离液态混合物中沸点不同的组分,可使用_____________________________;
(4)欲分离悬浮于液体中的固体物质,可使用_________________________________;
(5)欲用胆矾晶体(CuSO4·5H2O)制无水硫酸铜固体,可使用:___________________。
【答案】球形干燥管 分液漏斗 蒸馏烧瓶、酒精灯 漏斗 坩埚、酒精灯
【解析】
(1)干燥氨气用碱石灰,碱石灰属于固体干燥剂,应该盛放在干燥管中,所以欲干燥NH3需使用仪器为干燥管,故答案为:球形干燥管;
(2)分液漏斗用于分离互不相溶的两种液态物质,则欲分离互不相溶的两种液态物质,须使用分液漏斗,故答案为:分液漏斗;
(3)蒸馏烧瓶用于分离互溶的、沸点不同的液态混合物,则欲分离互溶的、沸点不同的液态混合物,须使用蒸馏烧瓶和酒精灯,故答案为:蒸馏烧瓶、酒精灯;
(4)漏斗用于分离不溶固体和液体混合物,则欲分离固体和液体物质,须使用漏斗,故答案为:漏斗;
(5)坩埚用于固体物质的加热,胆矾晶体(CuSO4·5H2O)加热蒸发结晶水可得到无水硫酸铜固体,须用坩埚和酒精灯,故答案为:坩埚、酒精灯。


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:
【题目】下图为反应 2H2(g)+O2(g)=2H2O(g)的能量变化示意图。 下列说法正确的是
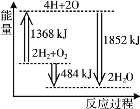
A.拆开 2 mol H2(g)和 1 mol O2(g)中的化学键成为H、O原子,共放出1368 kJ 能量
B.由 H、O 原子形成 2 mol H2O(g),共吸收1852 kJ 能量
C.2 mol H2(g)和 1 mol O2(g)反应生成 2 mol H2O(g),共放出484 kJ 能量
D.2 mol H2(g)和 1 mol O2(g)反应生成 2 mol H2O(l),ΔH>-484 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作合理或能达到实验目的的是
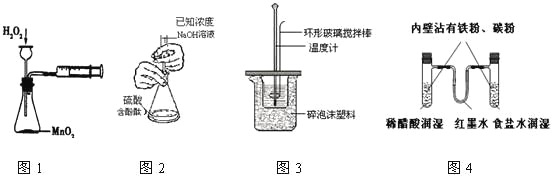
A.图1:实验目的是定量测定化学反应速率
B.图2:用标准NaOH溶液滴定待测H2SO4溶液的物质的量浓度
C.图3:将0.1mol/L 55mLNaOH溶液逐滴加入到0.1mol/L50mL盐酸溶液中测中和热
D.图4:模拟铁的腐蚀实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气净化中的一个反应如下:2NO(g)+2CO(g)N2(g)+2CO2(g),请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ·mol-l
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-l
2C(s)+O2(g)=2CO(g) △H=-221kJ·mol-l
则2NO(g)+2CO(g)N2(g)+2CO2(g)的△H=____kJ·mol-l。
(2)一定温度下,向体积为 1 L的密闭容器中充入一定量的NO和CO。在t1时刻达到平衡状态,此时n(CO)=0.1 mol,n(NO)=0.2 mol,n(N2)= a mol,且N2占平衡总体积的![]() 。
。
①则该反应的平衡常数K=______。若保持温度及容器体积不变,平衡后在此基础上再向容器中充入3a mol的N2、0.2 mol的NO,平衡将______移动(填“向左”、“向右”或“不”)。
②下列各种情况,可说明该反应已经达到平衡的是______。
A.v生成(CO2)= v消耗(CO)
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.NO、CO、N2、CO2的浓度均不再变化
E.单位时间内生成2n mol碳氧双键的同时消耗n molN≡N
③在t2时刻,将容器迅速压缩到原容积的![]() ,在其它条件不变的情况下, t3时刻达到新的平衡状态。请在图中补充画出t2-t3-t4时段,正反应速率的变化曲线_________。
,在其它条件不变的情况下, t3时刻达到新的平衡状态。请在图中补充画出t2-t3-t4时段,正反应速率的变化曲线_________。
(3)为避免汽车尾气中的有害气体对大气的污染,给汽车安装尾气净化装置。净化装置里装有含Pd等过渡元素的催化剂,气体在催化剂表面吸附与解吸作用的机理如下图所示。写出上述变化中的总化学反应方程式_________。
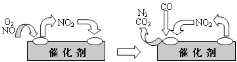
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向800mL稀硝酸中加入一定质量的铁粉,铁粉完全溶解后,放出NO气体![]() 标准状况
标准状况![]() ,同时溶液质量增加
,同时溶液质量增加![]() ,下列判断正确的是
,下列判断正确的是![]()
A.原溶液中投入铁粉物质的量是![]()
B.原溶液中的![]() 浓度是
浓度是![]()
C.反应后的溶液中![]() :
:![]() :1
:1
D.反应后的溶液中还可以溶解![]() 铜
铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g)![]() 2SO3(g)△H = -196.0 kJ.mol-1,测得反应的相关数据如下,下列说法正确的是( )
2SO3(g)△H = -196.0 kJ.mol-1,测得反应的相关数据如下,下列说法正确的是( )
容器1 | 容器2 | 容器3 | |
应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2 mol SO2、1mol O2 | 4mol SO3 | 2 mol SO3 |
平衡v正(SO2)/molL-1S-1 | v1 | v2 | v3 |
平衡c(SO3)/molL-1 | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
反应能量变化 | 放出a KJ | 吸收b KJ | 吸收c KJ |
物质的平衡转化率α | α1(SO2) | α2(SO3) | α3(SO2) |
平衡常数K | K1 | K2 | K3 |
A. v1< v2,c2<2c1B. K1> K3,p2>2p3
C.v1< v3,α1(SO2 ) <α2(SO3 ) D. c2>2c3,α2(SO3 )+α3(SO2 )<1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研制出的八硝基立方烷(结构如图所示,碳原子未画出)是一种新型高能炸药,爆炸分解得到无毒、稳定的气体,下列说法正确的是 ( )
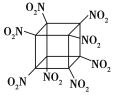
A. 分子中C、N间形成非极性键B. 1 mol该分子中含8 mol二氧化氮
C. 该物质既有氧化性又有还原性D. 该物质爆炸产物是NO2、CO2、H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含硫酸铝和氯化铝的混合溶液中逐滴加入氢氧化钡溶液至过量,加入氢氧化钡溶液的体积和所得沉淀的物质的量的关系如图所示。
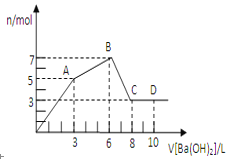
(1)氢氧化钡溶液浓度为_____________________。
(2)原混合溶液中SO42-和Cl-的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应类型判断不正确的是( )
A.HOCH2CH2CH2OH![]()
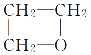 +H2O 消去反应
+H2O 消去反应
B.CH3CH2OH+CuO![]() CH3CHO+Cu+H2O 氧化反应
CH3CHO+Cu+H2O 氧化反应
C.H2C=CHCH=CH2+Cl2![]() CH2ClCH=CHCH2Cl 加成反应
CH2ClCH=CHCH2Cl 加成反应
D.ClCH2CH3+CH3NH2![]() CH3NHCH2CH3+HCl 取代反应
CH3NHCH2CH3+HCl 取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com