
【题目】向含硫酸铝和氯化铝的混合溶液中逐滴加入氢氧化钡溶液至过量,加入氢氧化钡溶液的体积和所得沉淀的物质的量的关系如图所示。
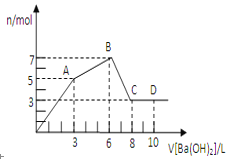
(1)氢氧化钡溶液浓度为_____________________。
(2)原混合溶液中SO42-和Cl-的物质的量之比为________。
【答案】1mol/L 1:2
【解析】
向含硫酸铝和氯化铝的混合溶液中逐滴加入氢氧化钡溶液至过量,反应的实质是铝离子与氢氧根离子、钡离子与硫酸根离子反应,结合方程式和图像分析解答。
(1)向含硫酸铝和氯化铝的混合溶液中逐滴加入氢氧化钡溶液至过量,反应的离子方程式有Ba2++SO42-=BaSO4↓、Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O。假设1mol硫酸铝中硫酸根完全被沉淀需要氢氧化钡是3mol,3mol氢氧化钡提供6mol氢氧根,1mol硫酸铝中含有2mol铝离子,二者恰好沉淀生成氢氧化铝。从起点到A点可以认为是硫酸铝与氢氧化钡反应生成3mol硫酸钡和2mol氢氧化铝。A到B是氯化铝和氢氧化钡反应,B点时溶液中铝离子完全沉淀,产生沉淀达最大值,溶液中溶质为BaCl2;B到C是氢氧化铝溶解在氢氧化钡中,C点时氢氧化铝完全溶解。根据图像可知溶解氢氧化铝消耗氢氧化钡8L-6L=2L,消耗氢氧化铝是7mol-3mol=4mol,所以需要氢氧化钡是2mol,则氢氧化钡溶液浓度为2mol÷2L=1mol/L;
(2)根据图像可知硫酸钡是3mol,所以硫酸铝是1mol,氯化铝产生的氢氧化铝是2mol,因此氯化铝是2mol,所以原混合溶液中SO42-和Cl-的物质的量之比为3mol:6mol=1:2。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】R、X、Y和Z是四种元素,其常见化合价均为+2价,且X2+与单质R不反应,X2++Z=X+Z2+,Y+Z2+=Y2++Z。这四种离子被还原成0价时,表现的氧化性强弱顺序为( )
A.R2+>X2+>Z2+>Y2+B.X2+>R2+>Y2+>Z2+
C.Y2+>Z2+>R2+>X2+D.Z2+>X2+>R2+>Y2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中溶质的物质的量浓度为1 mol/L的是( )
A. 将40gNaOH固体溶于1L水中
B. 将22.4 L氯化氢气体溶于水配成1L溶液
C. 将1L 10mol/L的浓盐酸与9L水混合
D. 将10g NaOH固体溶解在水中配成250 mL溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医用酒精和84消毒液混合使用可能发生反应:4NaClO+CH3CH2OH![]() HCCl3+HCOONa+NaCl+2NaOH+H2O,设NA为阿伏加德罗常数,下列叙述正确的是
HCCl3+HCOONa+NaCl+2NaOH+H2O,设NA为阿伏加德罗常数,下列叙述正确的是
A.含NA个ClO-的NaClO溶液中,Na+数目为NA
B.上述反应中,每生成1molNaCl,转移的电子数为8NA
C.100 g质量分数为46%的乙醇溶液中所含的氢原子数为6NA
D.标准状况下,2.24 L HCCl3含有的共用电子对的数目为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种新型的光化学电源,当光照射N型半导体时,通入O2和H2S即产生稳定的电流并获得H2O2 (H2AQ和AQ是两种有机物)。下列说法正确的是

A.甲池中的石墨电极是电池的负极
B.H+通过全氟磺酸膜从甲池进入乙池
C.甲池中石墨电极上发生的电极反应为AQ+2H+-2e-=H2AQ
D.总反应为 H2S + O2![]() H2O2 + S↓
H2O2 + S↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。
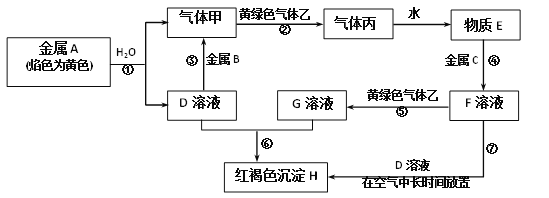
请根据以上信息完成下列各题:
(1)写出下列物质的化学式:B__________、丙__________。
(2)写出黄绿色气体乙的一种用途________________,反应过程⑦可能观察到的实验现象是_________________。
(3)写出反应①的化学方程式,并用单线桥法标出电子转移的方向和数目:______。
(4)反应③中的氧化剂是__________(写化学式,下同),反应④中的还原剂是________。
(5)写出反应⑤的离子方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化尿素[CO(NH2)2·H2O2]是一种漂白、消毒、增氧剂,常温下为白色晶体,易于贮运,一般条件下不易分解,可用30%的双氧水和饱和尿素溶液在一定条件下来合成。
实验原理:CO(NH2)2+H2O2![]() CO(NH2)2·H2O2
CO(NH2)2·H2O2
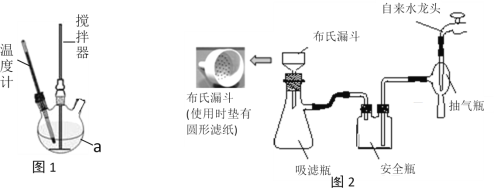
实验装置:实验室模拟制取装置如图1所示(部分仪器未画出)。
实验步骤:
步骤一:在250mL的仪器a中加入100mL30%的过氧化氢溶液,再加1 g NaH2PO4作稳定剂,开启搅拌器,通过仪器a右端瓶口缓慢加入50 g尿素,全部溶解后,控制温度在30℃左右,搅拌反应30分钟。
步骤二:将仪器a中的溶液用普通漏斗过滤,将滤液冷却到0℃,析出大量晶体,抽滤,烘干即得产品。
回答下列问题:
(1)仪器a 的名称是____________,制取过程中需控制n(H2O2):n[CO(NH2)2] =1.2 :1左右,并控制合成温度在30℃左右,其主要原因是__________________________________,控制反应温度的加热方法是________________。
(2)实验室一般用玻璃而非铁质搅拌器的原因是____________________________________。而实际生产中搅拌器选用的是铁质材料,但需将搅拌装置放在__________________(填试剂名称)中浸泡一段时间,使其表面钝化。
(3)①步骤二中“抽滤”按图2安装好装置,在布氏漏斗中放入滤纸,接下来的操作顺序是____________________→确认抽干(填标号)
a. 转移固液混合物 b. 开大水龙头 c. 微开水龙头 d. 加入少量蒸馏水润湿滤纸
②与用普通漏斗过滤相比,抽滤的主要优点是______________________________。
(4)过氧化尿素鉴定反应:在重铬酸钾酸性溶液中加入乙醚和少许过氧化尿素,振荡。上层乙醚呈蓝色,这是由于在酸性溶液中过氧化尿素中的过氧化氢与重铬酸钾反应生成较稳定的蓝色过氧化铬(CrO5:![]() ),重铬酸钾与H2O2反应的离子方程式为_______________。
),重铬酸钾与H2O2反应的离子方程式为_______________。
(5)过氧化尿素的合格产品中H2O2 的质量分数应不低于34%。为了确定某次实验产品合格与否,称取了该次样品12.0000g,溶于水配制成250mL溶液。移取25.00mL溶液于锥形瓶中,加入1mL 6mol/L的硫酸,然后用0.2000 mol/L KMnO4标准溶液滴定,三次滴定平均消耗KMnO4溶液20.00mL(KMnO4溶液与尿素不反应)。终点颜色变化为_____________。根据滴定结果通过计算判断该次实验产品质量为___________(填“合格”或“不合格”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:甲![]() 乙
乙![]() 丙。下列有关物质的推断不正确的是( )
丙。下列有关物质的推断不正确的是( )
A.若甲为焦炭,则丁可能是O2
B.若乙为Al(OH)3,则丁可能是NaOH
C.若甲为Fe,则丁可能是盐酸
D.若甲为NaOH溶液,则丁可能是CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据乙烯氧化成乙醛的反应,可设计成如图所示的电化学装置,下列说法不正确的是
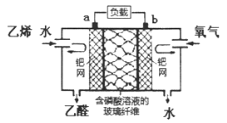
A.该电化学装置是原电池装置
B.电子移动方向:电极a→负载→电极b→磷酸溶液→电极a
C.a极反应式可表示为:CH2=CH2-2e-+H2O=CH3CHO+2H+
D.当b极消耗标准状况下氧气5.6L时,理论上玻璃纤维中有NA个H+从左往右移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com