
【题目】根据乙烯氧化成乙醛的反应,可设计成如图所示的电化学装置,下列说法不正确的是
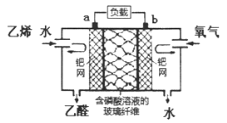
A.该电化学装置是原电池装置
B.电子移动方向:电极a→负载→电极b→磷酸溶液→电极a
C.a极反应式可表示为:CH2=CH2-2e-+H2O=CH3CHO+2H+
D.当b极消耗标准状况下氧气5.6L时,理论上玻璃纤维中有NA个H+从左往右移动
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】向含硫酸铝和氯化铝的混合溶液中逐滴加入氢氧化钡溶液至过量,加入氢氧化钡溶液的体积和所得沉淀的物质的量的关系如图所示。
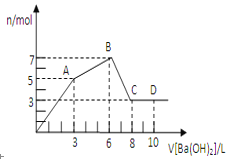
(1)氢氧化钡溶液浓度为_____________________。
(2)原混合溶液中SO42-和Cl-的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种水系锌离子电池总反应式为xZn+Zn1-xMn2O4![]() ZnMn2O4.(0<x<1)。下列说法错误的是( )
ZnMn2O4.(0<x<1)。下列说法错误的是( )
A.充电时,阳极的电极反应式为Zn1-xMn2O4+xZn2++2xe-=ZnMn2O4
B.放电时,Zn2+向正极迁移
C.充放电过程中锌与锰的化合价都发生变化
D.放电时,每转移1mole-正极质量增加32.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋(Bi)的化合物在电子、医药等领域应用广泛。由辉铋矿(主要成分为Bi2S3, 含杂质SiO2等,Bi2S3不溶于水和硫酸)制备Bi2O3的工艺如下。
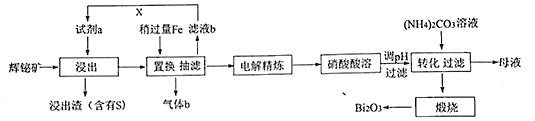
回答下列问题:
(1)试剂a最好选用的试剂是______________(填选项字母);
A. HCl溶液 B.浓H2SO4 C. H2O2溶液 D. FeCl3和HCl混合液
(2)辉铋矿的浸出液中铋元素主要以Bi3+形式存在,写出浸出过程生成S渣的离子方程式_______,“滤液b”中通入气体X后可循环利用,气体X是_______________ (写化学式);
(3)“抽滤”用如下装置完成,请选择字母代号补全正确的操作顺序(洗涤操作只做一次):

开抽气泵→a→b→d→ ____→c→ 关抽气泵;
a.转移固液混合物 b.关活塞A c.开活塞A d.确认抽干 e.加洗涤剂洗涤
(4)写出“煅烧”碱式碳酸铋[(BiO)2CO3]制备Bi2O3 的化学方程式____________________________;
(5)硝酸酸溶后调pH可得到碱式硝酸铋,碱式硝酸铋直接灼烧也能得到Bi2O3,上述工艺中却转化为碱式碳酸铋再灼烧,除了能改良产品性状,另一优点是__________________________________________;
(6)从“母液”中回收可用做炸药的物质是_________ ( 写物质名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Cl2+6NaOH![]() 5NaCl+NaClO3+3H2O,以下叙述正确的是( )
5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A. Cl2既做氧化剂又做还原剂
B. 被氧化的氯原子和被还原的氯原子的物质的量之比为5∶1
C. Cl2是氧化剂,NaOH是还原剂
D. 氧化剂得电子数与还原剂失电子数之比为5∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在汽车上安装高效催化转化器,可发生反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) △H,减少汽车尾气污染。某研究性学习小组在两个初始条件完全相同的恒温恒容密闭容器中充入一定量的NO和CO气体,甲组不加催化剂,乙组加入催化剂,分别用气体传感器测得不同时间的NO和CO浓度如表:
N2(g)+2CO2(g) △H,减少汽车尾气污染。某研究性学习小组在两个初始条件完全相同的恒温恒容密闭容器中充入一定量的NO和CO气体,甲组不加催化剂,乙组加入催化剂,分别用气体传感器测得不同时间的NO和CO浓度如表:
时间(s) | 甲 | 乙 | |||||||||||
0 | 1 | 2 | 3 | 4 | 5 | 0 | 1 | 2 | 3 | 4 | 5 | ||
c(NO)(×10-4mol/L) | 10.0 | 10.0 | 10.0 | 10.0 | 10.0 | 10.0 | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 | |
c(CO)(×10-3mol/L) | 3.60 | 3.60 | 3.60 | 3.60 | 3.60 | 3.60 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 | |
下列说法正确的是:
A.通过甲乙组数据对比可知,催化剂可以让原来不能自发进行的反应体系自发进行
B.根据化学反应原理综合分析可知:反应2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) 的△H<0
N2(g)+2CO2(g) 的△H<0
C.乙容器中,0~
D.达到平衡后,将容器乙中各物质的浓度均加倍,则体系K值增加,平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某澄清溶液中可能含有Na+、K+、NH4+、Mg2+、Fe2+、SO42﹣、SO32﹣、Cl﹣、I﹣、CO32﹣中的若干种,且离子浓度都相等。现取该溶液进行有关实验,实验结果如下图所示:
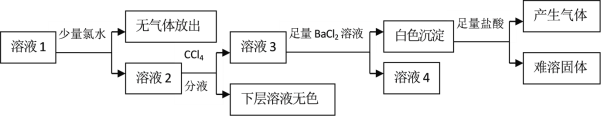
下列关于该溶液的说法中正确的是
A.通过CCl4层无色可以推知原溶液中一定不存在I-
B.向白色沉淀中加入盐酸产生气体并留有难溶固体可推知原溶液中存在SO32﹣和CO32-
C.该溶液中不可能同时存在NH4+和Cl-
D.另取该溶液加入足量浓NaOH溶液,加热,若试管口的湿润红色石蕊试纸不变蓝,则可确定原溶液中所有离子的存在情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐中常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:

提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-,选出a所代表的试剂,按滴加顺序依次为________(只填化学式)。
②分离操作①中所用到的玻璃仪器有____________。
③洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为________。
(2)用提纯的NaCl配制450 mL 4.00 mol·L-1NaCl溶液,所用仪器除药匙、烧杯、玻璃棒外还有________(填仪器名称)。
(3)在实验中多次用到玻璃棒,其作用有三个,分别是______________、______________、______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定CuSO4·xH2O晶体的x值,有关质量数据如表中所示,已知x的理论值为5.0,产生误差的可能原因是( )

A.晶体中含不挥发杂质B.加热时蓝色未完全变白
C.没有放在干燥器中冷却D.加热时有晶体溅出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com