
(1)估算锗的密度为___________________,比热为___________________。
(2)Ge(OH)4是酸性、碱性,还是两性氢氧化物?
(3)GeH4的热稳定性比SiH4强还是弱?
解析:锗是第ⅣA元素,它介于硅和锡之间,因此根据题目所给信息,可得锗的密度和比热应该是介于硅和锡之间,而且数据是它们的平均值。因此,锗的密度为(
答案:(1)


科目:高中化学 来源:导学大课堂必修二化学鲁科版 鲁科版 题型:043
19世纪中叶,人们根据元素周期表预言过第ⅣA族的锗(当时称为类硅)的性质.通常同一族中由上而下元素性质是逐渐变化,其中一种“未知”元素的物理性质的数值大约是上、下两种元素物理性质数据的中间值.当时已知密度——Si为4.8 g·cm-3,Sn为5.8 g·cm-3;比热——Sn为218 J·(kg·K)-1,Pb为130 J·(kg·K)-1.根据周期律完成下列问题:
(1)估算锗的密度为________,比热为________.
(2)Ge(OH)4是酸性、碱性,还是两性氢氧化物?
(3)GeH4的热稳定性比SiH4强还是弱?
查看答案和解析>>
科目:高中化学 来源: 题型:022
19世纪中叶,人们根据元素周期律预言过第ⅣA族锗(当时称为类硅)的性质.通常同一族中由上而下元素性质是逐渐变化时,中间元素的物理性质的数据是上下两种元素物理性质数据的中间值.已知密度: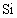
 、Sn
、Sn 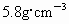 ,比热:Sn
,比热:Sn 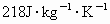 、Pb
、Pb 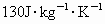 ,根据元素周期律推断:
,根据元素周期律推断:
(1)估计锗的物理性质:
密度_________比热____________.
(2)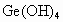 是酸性、碱性还是两性氢氧化物_____________.
是酸性、碱性还是两性氢氧化物_____________.
(3) 的稳定性比
的稳定性比 强还是弱__________.
强还是弱__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
A.XH4不稳定,但有强还原性
B.用焦炭可在高温下从XO2中冶炼出X
C.X单质的熔点比硅高
D.X最高价氧化物对应水化物化学式为X(OH)4,其酸性比H2SiO3强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com