
【题目】(1)某温度下KW=10-12,则0.05mol/LH2SO4溶液的pH=____ ,0.01mol/LNaOH溶液的pH=______ 。
(2)下列叙述中与盐类的水解有关的是(______)
①明矾和FeCl3可作净水剂
②实验室配制AlCl3溶液时,应先把它溶在较浓的盐酸中,然后加水稀释
③为保存FeCl3溶液,要在溶液中加少量盐酸
④用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
⑤实验室盛放Na2CO3溶液的试剂瓶应用橡皮塞,而不用玻璃塞
⑥NH4Cl与ZnCl2溶液可作焊接中的除锈剂
⑦长期使用硫酸铵,土壤酸性增强;草木灰与铵态氮肥不能混合施用
A.①④⑦ B.②⑤⑦ C.③⑥⑦ D.全部有关
(3)若1 mol N2完全转化为NH3的反应热为△H=-92 kJ/mol,拆开1 mol H—H键和1 mol N![]() N 键需要的能量分别是436 kJ和946 kJ,则拆开1 mol N—H键需要的能量是__________kJ。
N 键需要的能量分别是436 kJ和946 kJ,则拆开1 mol N—H键需要的能量是__________kJ。
(4)已知25℃ 时,醋酸的Ka=1.8×10-5 碳酸的Ka1=4.3×10-7 Ka2=5.6×10-11 。有①NaHCO3溶液②CH3COONa溶液③NaOH溶液④Na2CO3各25 mL,浓度均为0.1 mol·L-1四种溶液的pH由大到小的顺序为_________ (填序号)
(5)Na2CO3溶液加热后碱性增强,结合化学平衡移动原理解释原因:____________。
【答案】1 10 D 391 ③>④>①>② 溶液中存在:CO32-+H2O![]() HCO3- +OH-,温度升高,平衡正向移动c(OH-)增大,碱性增强
HCO3- +OH-,温度升高,平衡正向移动c(OH-)增大,碱性增强
【解析】
(1)0.05mol/LH2SO4溶液中c(H+)=0.05mol/L×2=0.1mol/L,根据pH=-lg c(H+)计算pH;0.01mol/LNaOH溶液中c(OH-)=0.01mol/L,根据c(H+)=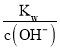 及pH=-lg c(H+)计算pH;
及pH=-lg c(H+)计算pH;
(2)①明矾溶于水后Al3+水解生成Al(OH)3胶体, Fe3+水解生成Fe(OH)3胶体;
②Al3+水解生成Al(OH)3;
③Fe3+水解生成Fe(OH)3;
④HCO3-与Al3+发生双水解;
⑤CO32-水解使溶液显碱性;
⑥NH4+与Zn2+水解使溶液显酸性;
⑦NH4+水解使溶液显酸性,草木灰的主要成分为K2CO3,CO32-水解使溶液显碱性;
(3)根据△H=反应物的总键能-生成物的总键能进行计算;
(4)Ka越大,酸性越强,其对应的盐的水解程度越小;
(5)CO32-水解使溶液呈碱性,升高温度,平衡正移。
(1)0.05mol/LH2SO4溶液中c(H+)=0.05mol/L×2=0.1mol/L,pH=-lg c(H+)=-lg10-1=1;0.01mol/LNaOH溶液中c(OH-)=0.01mol/L,c(H+)=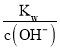 =
=![]() =10-10mol/L,因此pH=-lg c(H+)=-lg10-10=10;
=10-10mol/L,因此pH=-lg c(H+)=-lg10-10=10;
(2)①明矾溶于水后Al3+水解生成Al(OH)3胶体, Fe3+水解生成Fe(OH)3胶体,均可作净水剂,与盐类的水解有关;
②Al3+水解生成Al(OH)3,把AlCl3溶在较浓的盐酸中可抑制Al3+水解,与盐类的水解有关;
③Fe3+水解生成Fe(OH)3,保存FeCl3溶液时,在溶液中加少量盐酸可抑制Fe3+水解,与盐类的水解有关;
④HCO3-与Al3+发生双水解,生成Al(OH)3沉淀和CO2,可作泡沫灭火剂,与盐类的水解有关;
⑤CO32-水解使溶液显碱性,碱与玻璃中的SiO2反应生成Na2SiO3,与盐类的水解有关;
⑥NH4+与Zn2+水解使溶液显酸性,酸能除锈,与盐类的水解有关;
⑦NH4+水解使溶液显酸性,土壤酸性增强;草木灰的主要成分为K2CO3,CO32-水解使溶液显碱性,草木灰与铵态氮肥混合后可发生双水解,不能混用,与盐类的水解有关;
因此全部与盐类的水解有关;
(3)△H=反应物的总键能-生成物的总键能=946+3×436-2×3×E(N-H)=-92,解得E(N-H)= 391 kJ/mol;
(4)Ka越大,酸性越强,其对应的盐的水解程度越小,浓度均为0.1 mol·L-1四种溶液pH最大的是NaOH,酸性CH3COOH>H2CO3>HCO3-,因此四种溶液的pH由大到小的顺序为③>④>①>②;
(5)CO32-水解使溶液呈碱性,反应为CO32-+H2O![]() HCO3- +OH-,升高温度,平衡正移,c(OH-)增大,碱性增强。
HCO3- +OH-,升高温度,平衡正移,c(OH-)增大,碱性增强。


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】除去燃煤烟气中的有毒气体,一直是重要的科研课题。某科研小组设计如下装置模拟工业脱硫脱氮,探究SO2和NO同时氧化的吸收效果。模拟烟气由N2(90.02 %)、SO2(4.99%)、NO(4.99%)混合而成,各气体的流量分别由流量计控制,调节三路气体相应的流量比例,充分混合后进入A。(已知:FeSO4+NO![]() [Fe( NO)]SO4(棕色),下列说法不正确的是
[Fe( NO)]SO4(棕色),下列说法不正确的是

A. 反应开始前应该关闭d,打开e,通入一段时间的N2
B. 观察到装置A中有黑色固体生成,则A中反应为2H2O+3SO2+2MnO4—==3SO42—+2MnO2↓+4H+
C. 洗气瓶A的出气管口有两个玻璃球泡,目的是为了消除可能存在的未破裂的气泡
D. 实验中观察到B中红色褪去,C中变为浅棕色,说明KMnO4不能吸收NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g) 4NO2(g)+ O2(g) △H >0, T1温度下的部分实验数据为
t/s | 0 | 500 | 1000 | 1500 |
c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法不正确的是( )
A.500s内N2O5分解速率为2.96×10-3 mol/(L·s)
B.T1温度下的平衡常数为K1=125,1000s时N2O5转化率为50%
C.T1温度下的平衡常数为K1 ,T2温度下的平衡常数为K2,若K1<K2,则T1 >T2
D.平衡后其他条件不变,将容器的体积压缩到原来的1/2,则再平衡时c(N2O5) >5.00mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理和原电池原理是电化的两个重要内容。某兴趣小组做如下探究实验:
(1)如图为某实验小组依据氧化还原反应设计的原电池装置,该反应的离子方程式为_____________。反应前,电极质量相等,一段时间后,两电极质量相差12g,导线中通过_______mol电子。

(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极的反应式为________________。
(3)如图,其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,乙装置中石墨(2)电极上发生的反应式为_________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y形管是一种特殊的仪器,与其他仪器组合可以进行某些实验探究。利用如图装置可以探究SO2与BaCl2反应生成BaSO3沉淀的条件。下列判断正确的是

A. e、f两管中的试剂可以分别是浓氨水和NaOH固体
B. 玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应
C. c、d两根导管都必须插入BaCl2溶液中,保证气体与Ba2+充分接触
D. Y形管乙中产生的为氧化性气体,将BaSO3氧化为BaSO4沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铝在现代生产和日常生活中应用广泛。
(1)工业上用电解熔融氧化铝的方法来制取金属铝。
①金属铝在_______(填电极名称)生成。
②电解过程中作阳极的石墨易消耗,原因是_______。
(2)英国《自然》杂志近期报道了一种新型可充铝离子电池,以金属铝和石墨为电极,用AlCl4—和有机阳离子构成电解质溶液,其放电工作原理如图所示。
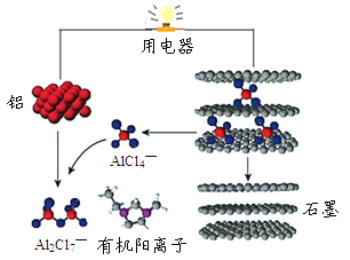
①电池放电时负极的电极反应式为_____。
②充电时有机阳离子向________电极移动(填“铝”或“石墨”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不能用勒夏特列原理解释的事实是
A. 红棕色的NO2加压后颜色先变深后变浅
B. 氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深
C. 黄绿色的氯水光照后颜色变浅
D. 合成氨工业使用高压以提高氨的产量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含少量铁,铝,铜等金属化合物)作脱硫剂,通过如下简化流程,既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。

请回答下列问题:
(1)上述流程脱硫实现了________(选填编号)。
a.废弃物的综合利用 b.白色污染的减少 c.酸雨的减少 d.臭氧层空洞的减少
(2)步骤I生成无水MnSO4的化学方程式是________。步骤IV生成无水MnO2的化学方程式是________。
(3)步骤I中,用MnCO3能除去溶液中Al3+和Fe3+,其原因是_______。滤渣M的成分是________。铜元素以________形式存在于滤渣N中。(写化学式)
(4)产品MnO2可作超级电容材料,用惰性电极电解MnSO4溶液可以制得MnO2,则MnO2在________生成。(填电极名称)
(5)假设脱除的SO2只与软锰矿浆中MnO2反应。按照图示流程,将2.0m3(标准状况)含SO2的体积分数为60%的尾气通入矿浆,若SO2的脱除率为89.6%,最终得到MnO2的质量10.44kg。则在除去铁、铝、铜、镍等杂质的过程中,所引入的锰元素为________kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某原子结构示意图为 ,下列有关说法正确的是( )
,下列有关说法正确的是( )
A. 结构示意图中x=4
B. 该原子的电子排布式为1s22s22p63s23p4
C. 该原子的电子排布图为![]()
D. 该原子结构中共有5个能级上填充有电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com