
【题目】用系统命名法写出下列物质名称或结构简式或者对应的化学方程式:
(1) ______________________________。
______________________________。
(2)实验室制取乙炔的化学方程式为:_________________________________________。
(3)乙醇的消去反应:________________________________________________;
(4)3-甲基-1-丁烯:_________________________________________。
【答案】3,3,6-三甲基辛烷 CaC2+2H2O→Ca(OH)2+C2H2↑ ![]() CH2=CHCH2(CH3)2
CH2=CHCH2(CH3)2
【解析】
(1)考察烷烃的系统命名法;烷烃的命名规则:①找最长的碳链作主链,记为某烷;②给支链编号,编号和要最小;③合并取代基,取代基小的,放在最前边,数字和数字之间用“,”连接,数字和汉子之间用“-”连接;
(2)考察乙炔的实验室制法,实验室一般使用电石和饱和食盐水反应制得乙炔;
(3)考察乙醇的消去反应,乙醇的消去反应是羟基的消去,浓硫酸作催化剂,加热温度为170℃;
(4)考察有机物的书写。
(1)该物质的碳链及支链的正确编号为: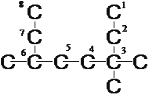 ,所以烷烃的系统命名为3,3,6-三甲基辛烷;
,所以烷烃的系统命名为3,3,6-三甲基辛烷;
(2)实验室制取乙炔的化学方程式为:CaC2+2H2O→Ca(OH)2+C2H2↑;
(3)乙醇的消去反应为:![]()
(4)3-甲基-1-丁烯的结构简式为:CH2=CHCH2(CH3)2。


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】某制糖厂以甘蔗为原料制糖,同时得到大量的甘蔗渣,对甘蔗渣进行综合利用不仅可以提高综合效益,而且还能防止环境污染,生产流程如图:
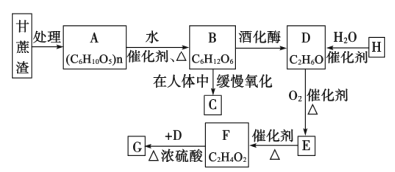
已知:石油裂解已成为生产H的主要方法,G是具有香味的液体。回答下列问题:
(1)H中的官能团名称为____________;E的名称为____________。
(2)H→D的化学反应类型为____________。
(3)实验室中制备G的反应装置如图所示:
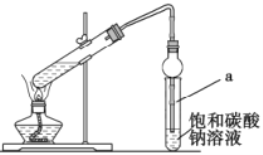
①与教材中采用的实验装置不同,此装置中采用了球形干燥管,其作用是____________。饱和碳酸钠溶液的作用____________。
②实验结束后,若要分离试管a中的G需要用到的主要玻璃仪器是____________、烧杯。
③若实验中用含18O的D与F反应则F→G的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1 mol·L-1 NaOH溶液滴定20 mL 0.1 mol·L-1 HX溶液,溶液的pH随加入NaOH溶液体积变化如图。下列说法不正确的是

A. HX为弱酸
B. V1 <20
C. M点溶液中离子浓度由大到小的顺序为:c(X-)>c(Na+)>c(H+)>c(OH-)
D. 二者等体积混合时,c(Na+)=c(X-) + c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。

下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C―H键发生断裂
C. ①→②放出能量并形成了C―C键
D. 该催化剂可有效提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代工业的发展导致CO2的大量排放,对环境造成的影响日益严重,通过各国科技工作者的努力,已经开发出许多将CO2回收利用的技术,其中催化转化法最具应用价值。回答下列问题:
(1)在催化转化法回收利用CO2的过程中,可能涉及以下化学反应:
①CO2(g)+2H2O(1)![]() CH3OH(1)+
CH3OH(1)+![]() O2(g) △H=+727kJ·mol-1 △G=+703kJ·mol-1
O2(g) △H=+727kJ·mol-1 △G=+703kJ·mol-1
②CO2(g)+2H2O(1)![]() CH4(g)+2O2(g) △H=+890kJ·mol-1 △G=+818kJ·mol-1
CH4(g)+2O2(g) △H=+890kJ·mol-1 △G=+818kJ·mol-1
③CO2(g)+3H2(g)![]() CH3OH(1)+H2O(1) △H=-131kJ·mol-1 △G=-9.35kJ·mol-1
CH3OH(1)+H2O(1) △H=-131kJ·mol-1 △G=-9.35kJ·mol-1
④CO2(g)+4H2(g)![]() CH4(g)+2H2O(1) △H=-253kJ·mol-1 △G=-130kJ·mol-1
CH4(g)+2H2O(1) △H=-253kJ·mol-1 △G=-130kJ·mol-1
从化学平衡的角度来看,上述化学反应中反应进行程度最小的是____,反应进行程度最大的是_____。
(2)反应CO2(g)+4H2(g)=CH4(g) +2H2O(g)称为Sabatier反应,可用于载人航空航天工业。我国化学工作者对该反应的催化剂及催化效率进行了深入的研究。
①在载人航天器中利用Sabatier反应实现回收CO2再生O2,其反应过程如图所示,这种方法再生O2的最大缺点是需要不断补充_________(填化学式)。

②在1.5 MPa,气体流速为20 mL·min-l时研究温度对催化剂催化性能的影响,得到CO2的转化率(%)如下:
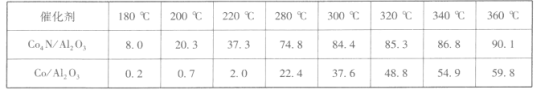
分析上表数据可知:_____(填化学式)的催化性能更好。
③调整气体流速,研究其对某一催化剂催化效率的影响,得到CO2的转化率(%)如下:
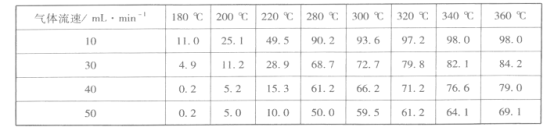
分析上表数据可知:相同温度时,随着气体流速增加,CO2的转化率____(填“增大”或“减小”),其可能的原因是_________________________________。
④在上述实验条件中,Sabatier反应最可能达到化学平衡状态的温度是____,已知初始反应气体中V(H2):V(CO2) =4:l,估算该温度下的平衡常数为 ___________(列出计算表达式)。
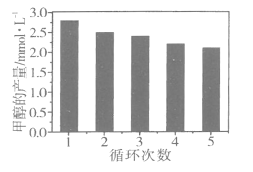
(3)通过改变催化剂可以改变CO2与H2反应催化转化的产物,如利用Co/C作为催化剂,反应后可以得到含有少量甲酸的甲醇。为了研究催化剂的稳定性,将Co/C催化剂循环使用,相同条件下,随着循环使用次数的增加,甲醇的产量如图所示,试推测甲醇产量变化的原因_________________________________。(已知Co的性质与Fe相似)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.中国的侯德榜对索尔维制碱法进行了改进,将合成氨工业与纯碱工业联合,发明了侯氏制碱法,又称联合制碱法,生产流程可以表示如图所示(![]() 代表所需物质,
代表所需物质,![]() 代表产品)
代表产品)
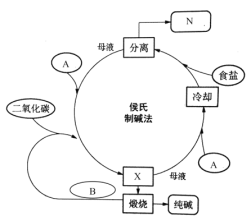
在上述工业流程中:
(1)产品N的化学式__________,所需物质A的名称____________,B的电子式____________。
(2)侯德榜制碱法的原理是_____________________________________(用化学方程式表示)。操作X的名称是_________________________。
II.利用侯德榜原理制备的纯碱中含有少量NaCl等杂质,利用下列装置可用来测定纯碱中的Na2CO3的质量分数。
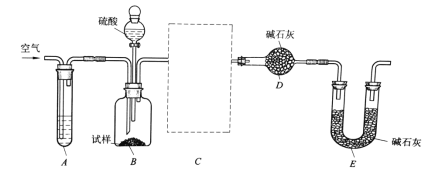
实验步骤如下:
①如图所示,组装好实验仪器,并检查其气密性;
②准确称取盛有碱石灰的干燥管D的质量(设为m1g);
③准确称取一定量的纯碱(设为ng),并将其放进广口瓶B内;
④从分液漏斗中缓缓滴入一定量的稀硫酸,并从前端缓缓地鼓入空气,至B反应器中不再产生气体为止;
⑤准确称取干燥管D的总质量(设为m2g)
根据上述实验,回答下列问题:
(3)该实验进行到操作④时,要缓缓鼓入空气,鼓入空气的作用是__________________________。装置A中的液体应选用___________。
(4)装置B与D之间必须添加一装置C,否则使测定结果偏高。在空白框内画出该装置C,装置中盛放的是__________。
(5)根据此实验,计算出纯碱中Na2CO3的质量分数为_________________(用m1、m2、n表示)。如果缺少装置E,则实验所得纯碱样品的纯度会_________(“偏高”、“偏低”、或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国圣路易斯大学研制了一种新型的乙醇电池,其反应为:C2H5OH+3O2→ 2CO2+3H2O,电池示意如右图,下列说法正确的是
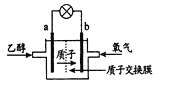
A. a极为电池的正极
B. b极发生氧化反应
C. 负极的反应为:4H++O2+4e-===2H2O
D. 电池工作时,1mol乙醇被氧化时有12mol转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种重要的基本化工原料,其分子中碳元素的百分含量为85.7%,且相对分子量小于30。A、B、C、D、E、F、G、H有下图所示的转化关系(部分产物已略去)。其中B为高分子化合物,C为无色无味气体,实验室中可以通过G与大理石制取。D为烃,不能使酸性高锰酸钾溶液褪色。E、G为生活中常见的有机物,且E有特殊香味,H有香味。
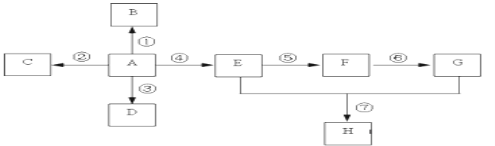
(1)写出下列各物质的官能团的名称:A ___________;E ___________;
(2)按要求写出下列各步变化的化学方程式
反应①__________________;
反应⑤_____________________;
反应⑦ _______________________。
(3)写出下列反应类型:反应④___________,反应⑤___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物的结构式如图,其中W、X、Y、Z为原子序数依次增大的短周期元素,Y原子核外最外层电子数是其电子层数的3倍,X与Z位于不同的周期,下列有关说法正确的是

A.气态氢化物的热稳定性:X>Y
B.X、W、Z三者形成的化合物都是液体
C.W2Y2中既含极性键又含非极性键
D.Z元素形成的含氧酸全部是强酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com