
| A. | Ca(ClO)2溶液中通入过量的二氧化硫气体:ClO-+SO2+H2O═HClO+HSO3- | |
| B. | 向Ba(NO3)2溶液中通入过量SO2:3Ba2++3SO2+2NO3-+2H2O═2NO↑+3BaSO4↓+4H+ | |
| C. | 稀硝酸中加入过量铁粉:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| D. | 向碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- |
分析 A.HClO与HSO3-发生氧化还原反应;
B.向Ba(NO3)2溶液中通入过量SO2,硝酸根离子全被被还原;
C.稀硝酸中加入过量铁粉反应生成亚铁离子;
D.向碳酸氢钙溶液中加入过量的氢氧化钠溶液,生成碳酸钙沉淀和碳酸根离子.
解答 解:A.次氯酸钙溶液中通入过量的二氧化硫气体CIO-+H2O+Ca2++SO2═CaSO4↓+2H++CI-,故A错误;
B.向Ba(NO3)2溶液中通入过量SO2,硝酸根离子全被被还原,应为Ba2++3SO2+2NO3-+2H2O═2NO↑+BaSO4↓+4H++2SO42-,故B错误;
C.稀硝酸中加入过量铁粉反应生成亚铁离子,应为3Fe+8H++2NO3-═3Fe3++2NO↑+4H2O,故C错误;
D.向碳酸氢钙溶液中加入过量的氢氧化钠溶液,生成碳酸钙沉淀和碳酸根离子,为Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32-,故D正确.
故选D.
点评 本题考查了离子方程式的正误判断,为高频考点,侧重于学生的分析能力的考查,题目难度中等,试题侧重于元素化合物的性质的综合应用,注意物质的化学式、电荷守恒和质量守恒的判断.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 浓硝酸与铜反应制取二氧化氮 | B. | 碳化钙与食盐水反应制取乙炔 | ||
| C. | 浓氨水和生石灰反应制取氨气 | D. | 浓盐酸和二氧化锰反应制取氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 性状 | 熔点/℃ | 沸点/℃ | 水溶性 | |
| N2H4 | 无色液体 | 1.4 | 113 | 与水混溶 |
| N2H6SO4 | 无色晶体 | 254 | / | 微溶于冷水,易溶于热水 |
| 步骤 | 操作 | 现象 |
| I | 取10g NaClO固体,加入100mL水 | 固体溶解,溶液呈碱性 |
| II |  | 液面上方出现白雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
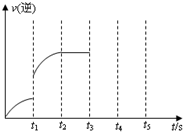 一定温度下在体积为5L的密闭容器中发生可逆反应.
一定温度下在体积为5L的密闭容器中发生可逆反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 特氟隆(聚四氟乙烯)的单体是氟利昂 | |
| B. | 蛋白质是由氨基酸形成的可水解的高分子化合物,其水溶液有丁达尔现象 | |
| C. | 聚丙烯的结构简式为: | |
| D. | 石英的化学式为CaSiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氢能被视作连接化石能源和可再生能源的重要桥梁.
氢能被视作连接化石能源和可再生能源的重要桥梁. ;与氨硼烷互为等电子体的有机化合物是CH3CH3(写结构简式).
;与氨硼烷互为等电子体的有机化合物是CH3CH3(写结构简式). .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com