
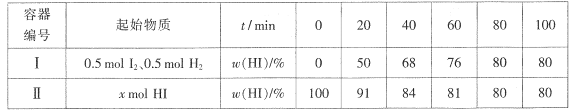
【题目】Boderlscens研究反应:H2(g)+I2(g) ![]() 2HI(g) △H<0.温度T时,在两个体积均为1L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数ω(HI)与反应时间t的关系如下表:
2HI(g) △H<0.温度T时,在两个体积均为1L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数ω(HI)与反应时间t的关系如下表:
研究发现上述反应中![]() 其中
其中![]() 为常数。下列说法正确的是
为常数。下列说法正确的是
A. 温度为T时该反应的![]()
B. 容器I中前20 min的平均速率v(HI)=0.0125mol.L-1.min-1
C. 若起始时,向容器I中加入物质的量均为0.l mol的H2、I2、HI,反应逆向进行
D. 若两容器中![]() 且
且 ![]() 则x的值一定为1
则x的值一定为1
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,五种元素核内质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)A2W的电子式为________。
(2)B中质子数和中子数相等的核素符号为____,E元素在周期表中的位置为_______ 。
(3)W、D、E三种元素的简单离子半径由小到大的顺序为_______(填离子符号)。
(4)在一定条件下,D元素的单质能与A元素的单质化合生成DA,DA能与水反应放氢气,则其化学方程式为_______,若将1molDA和1molE单质混合加入足量的水,充分反应后生成气体的体积是______L(标准状况下)。
(5)若要比较D和E的金属性强弱,下列实验方法可行的是_______。
a.将D单质置于E的盐溶液中,若单质D不能置换出单质E,说明D的金属性弱
b.将少量D、E的单质分别投入到水中,若D反应而E不反应,说明D的金属性强
C.比较相同条件下D和E的最高价氧化物对应水化物的溶解性若前者比后者溶解度大,说明D的金属性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝石墨双离子电池是一种全新低成本、高效电池。原理为:A1Li+Cx(PF6)![]() Al+xC+Li++PF6-。电池结构如图所示。下列说法正确的是
Al+xC+Li++PF6-。电池结构如图所示。下列说法正确的是

A. 放电时,外电路中电子向铝锂电极移动
B. 放电时,正极反应为Cx(PF6)+e-=xC+PF6-
C. 充电时,应将铝石墨电极与电源负极相连
D. 充电时,若电路中通过1 mol电子,阴极质量增加9 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 镀铜铁制品镀层受损后,铁制品比受损前更容易生锈
B. 等物质的量浓度的CH3COOH溶液和HCl溶液中,水的电离程度相同
C. 0.1 mol·L-1NH4Cl溶液加水稀释,![]() 的值减小
的值减小
D. 对于反应2SO2+O2![]() 2SO3,使用催化剂能加快反应速率和提高SO2的平衡转化率
2SO3,使用催化剂能加快反应速率和提高SO2的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图是从元素周期表中截取下来的,甲、乙、丙为短周期主族元素,下列说法中正确的是( )
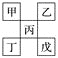
A. 丁一定是金属元素,其金属性比丙强
B. 丙的最高价氧化物水化物显强酸性
C. 乙的氢化物是以分子形式存在,且分子间存在氢键
D. 戊的原子序数一定是甲的5倍,且原子半径比甲大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g) 在不同温度下的平衡常数如表:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 42.9 | 50.7 | 64.0 |
请回答下列问题:
(1)该反应的平衡常数表达式 K= , △H0(填“>”、“<”或“=”).
(2)在一个容积为10L的密闭容器中,1300℃时加入 Fe、Fe2O3、CO、CO2各1mol,反应经过10min 后达到平衡.求该时间范围内反应的平均反应速率 v(CO2)= , CO 的平衡转化率为 .
(3)欲提高(2)中CO的平衡转化率,可采取的措施是 .
A.增加Fe2O3的量
B.加入合适的催化剂
C.移出部分CO2
D.提高反应温度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用新技术减少氮氧化物、SO2等物质的排放,可促进社会主义生态文明建设。
(1)采用“联合脱硫脱氮技术” 处理烟气(含CO2、SO2、NO)可获得含CaCO3、CaSO4、Ca(NO2)2的副产品,工业流程如图所示。
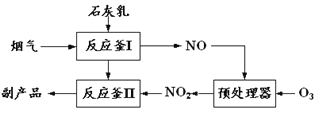
①反应釜I采用“气—液逆流”接触吸收法(如图),其优点是_____。
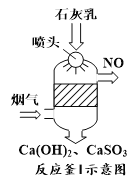
②反应釜II中CaSO3转化为CaSO4的化学反应方程式为_____。
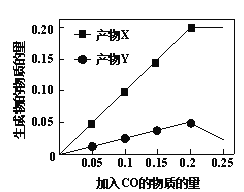
(2)为研究“CO还原SO2”的新技术,在反应器中加入0.10 mol SO2,改变加入CO的物质的量,反应后体系中产物随CO的变化如图所示。其中产物Y的化学式是____。
(3)O2/CO2燃烧技术是指化石燃料在O2和CO2的混合气体中燃烧而不是在空气中燃烧,通过该燃烧技术可收集到高纯度的CO2。
①与在空气中燃烧相比,利用O2/CO2燃烧技术,烟气中NOx的排放量明显降低,其主要原因是_____。
②利用太阳能可实现反应:2CO2(g)=2CO(g)+O2(g),该反应能自发进行的原因是______。
③700℃时,以Ni-MgO/γ-Al2O3作催化剂,向2 L密闭容器中通入CO2和CH4各3 mol,发生反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g),反应达平衡时测得 CO的体积分数为40%,CO2的平衡转化率为_____。
2CO(g)+2H2(g),反应达平衡时测得 CO的体积分数为40%,CO2的平衡转化率为_____。
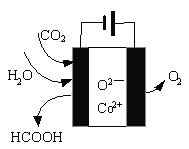
④CO2在新型钴基电催化剂作用下可转化为清洁燃料—甲酸。其工作原理如图所示,写出生成甲酸的电极反应式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①能量越低的物质就越稳定,②白磷转化成红磷是放热反应。据此,下列说法不正确的是
A.在相同的条件下,红磷比白磷稳定B.红磷和白磷的结构不同,互为同位素
C.白磷分子之间存在范德华力D.白磷容易发生自燃而红磷则不易自燃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com