
【题目】有四种短周期元素,它们的结构、性质等信息如下表所述:
元素 | 结构、性质等信息 |
A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
B | B与A同周期,其最高价氧化物的水化物呈两性 |
C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
请根据表中信息填写:
(1)A原子的核外电子排布式______。
(2)离子半径:B____A(填“大于”或“小于”)。
(3)C原子的电子排布图是____,其原子核外有___个未成对电子,能量最高的电子为___轨道上的电子,其轨道呈____形。
(4)D原子电子所占原子轨道数为_______个,D﹣的结构示意图是_____。
(5)BD3的水溶液显______性,原因_____________________(用离子方程式表示)。
【答案】1s22s22p63s1 小于 ![]() 3 2p 哑铃 9
3 2p 哑铃 9 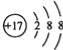 酸性 Al3++3H2O 3H++Al(OH)3
酸性 Al3++3H2O 3H++Al(OH)3
【解析】
A是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂,所以A为Na元素;B与A同周期,其最高价氧化物的水化物呈两性,则B为Al元素;C元素的气态氢化物极易溶于水,可用作制冷剂,则C为N元素;D是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂,则D为Cl元素。
(1)A为钠元素,A原子的核外电子排布式1s22s22p63s1,故答案为:1s22s22p63s1;(2)A为钠元素,B为铝元素,电子层数相同的离子,核电荷数越大,离子半径半径越小,所以铝离子半径小于钠离子,故答案为:小于;
(3)C为氮元素,C原子的基态原子的电子排布图是![]() ,其原子核外有3个未成对电子,能量最高的电子为2p轨道上的电子,其轨道呈哑铃,
,其原子核外有3个未成对电子,能量最高的电子为2p轨道上的电子,其轨道呈哑铃,
故答案为:![]() ;3;2p;哑铃;
;3;2p;哑铃;
(4)D为氯元素,氯原子核外电子排布式为:1s22s22p63s23p5,电子所占原子轨道数为9个;Cl-的结构示意图为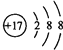 ,故答案为:9;
,故答案为:9;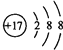 ;
;
(5)B为铝元素,D为氯元素,BD3为AlCl3,AlCl3在溶液中水解,使溶液显酸性,水解的离子方程式为Al3++3H2O 3H++Al(OH)3,故答案为:Al3++3H2O 3H++Al(OH)3。


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
【题目】有机物G(1,4-环己二醇)是重要的医药中间体和新材料单体,可通过以下流程制备。

完成下列填空:
(1)写出C中含氧官能团名称_____________。
(2)判断反应类型:反应①_______________;反应③_________________。
(3)写出B的结构简式 _____________________。
(4)一定条件下D脱氢反应得一种产物,化学性质比较稳定,易取代、难加成。该产物属于_________(填有机物类别),说明该物质中碳碳键的特点____________________________。
(5)1,3-丁二烯是应用广泛的有机化工原料,它是合成D的原料之一,它还可以用来合成氯丁橡胶(![]() )。写出以1,3-丁二烯为原料制备氯丁橡胶的单体的合成路线。_________________
)。写出以1,3-丁二烯为原料制备氯丁橡胶的单体的合成路线。_________________
(合成路线常用的表示方式为:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2和氮氧化物的转化和综合利用既有利于节约资源,又有利于保护环境。
(1)H2还原法是处理燃煤烟气中SO2的方法之一。已知:
2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH=a kJ·mol—1
H2S(g)=H2(g)+S(s) ΔH=b kJ·mol—1
H2O(l)=H2O(g) ΔH=c kJ·mol—1
写出SO2(g)和H2(g)反应生成S(s)和H2O(g)的热化学方程式:____________。
(2)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的反应为:2SO2(g)+O2(g)![]() 2SO3(g)。若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2[其中n(SO2) ∶n(O2)=2∶1],测得容器内总压强与反应时间如图所示。
2SO3(g)。若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2[其中n(SO2) ∶n(O2)=2∶1],测得容器内总压强与反应时间如图所示。

①图中A点时,SO2的转化率为____________。
②在其他条件不变的情况下,测得T2℃时压强的变化曲线如图所示,则C点的正反应速率vc(正)与A点的逆反应速率vA(逆)的大小关系为vc(正)______vA(逆)(填“>”、“<”或“=”)。
③图中B点的压强平衡常数Kp=_______________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)利用脱氮菌可净化低浓度NO废气。当废气在塔内停留时间均为90s的情况下,测得不同条件下NO的脱氮率如图Ⅰ、Ⅱ所示。

①由图I知,当废气中的NO含量增加时,宜选用_________法提高脱氮效率。
②图Ⅱ中,循环吸收液加入Fe2+、Mn2+提高了脱氮的效率,其可能原因为____________。
⑷研究表明:NaClO2/H2O2酸性复合吸收剂可同时有效脱硫、脱硝。图Ⅲ所示为复合吸收剂组成一定时,温度对脱硫脱硝的影响。
①写出废气中的SO2与NaClO2反应的离子方程式:____________________________。
②温度高于60℃后,NO去除率随温度升高而下降的原因为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。

回答下列问题:
(1)写出A的电子式___________。
(2)B、D分子中的官能团名称分别___________、___________。
(3)写出下列反应的反应类型:①___________,②___________,④___________。
(4)写出下列反应的化学方程式:
①_____________________________________。
②_____________________________________。
④_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素A、B、C都是短周期元素,A元素原子的2p轨道上只有两个未成对电子,B的3p轨道上有空轨道,A、B同主族,B、C同周期,C是本周期中电负性最大的.
请回答:
(1)A原子的核外电子排布的电子排布图 ______________ ,B原子的核外电子排布式________,C原子的价电子排布式____________。
(2)A、B、C的气态氢化物的化学式分别是___________,其中最不稳定的是__________。
(3)它们的最高价氧化物的水化物中,酸性最强的是_________。
(4)AC4的化学式___________,结构式__________,中心原子A的杂化方式________杂化,是__________(填“极性”或“非极性”)分子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的Ca2+、Mg2+、![]() 及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。下列操作顺序中最合适的是
及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。下列操作顺序中最合适的是
A.①④②⑤③B.④①②⑤③C.②⑤④①③D.⑤②④③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M是有机合成的重要中间体,制备M的一种合成路线如下(部分反应条件和试剂略去):

已知:①A的密度是相同条件下H2密度的38倍;其分子的核磁共振氢谱中有3组峰;
② (-NH2容易被氧化);
(-NH2容易被氧化);
③ R-CH2COOH
R-CH2COOH
请回答下列问题:
(1)B的化学名称为______。A中官能团的电子式为______。
(2)C![]() D的反应类型是______,I的结构简式为______。
D的反应类型是______,I的结构简式为______。
(3)F![]() G的化学方程式为______。
G的化学方程式为______。
(4)M不可能发生的反应为______(填选项字母)。
a.加成反应 b.氧化反应 c.取代反应 d.消去反应
(5)请写出任意两种满足下列条件的E的同分异构体有______。
①能与FeCl3溶液发生显色反应 ②能与NaHCO3反应 ③含有-NH2
(6)参照上述合成路线,以![]() 为原料(无机试剂任选),设计制备
为原料(无机试剂任选),设计制备![]() 的合成路线:______。
的合成路线:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列粒子的描述不正确的是( )
A. PH3的电子式为![]() ,其热稳定性不如NH3
,其热稳定性不如NH3
B. HS-的电子式为![]() ,是含有极性键的18电子的粒子
,是含有极性键的18电子的粒子
C. CH2Cl2的电子式为![]() ,是结构呈正四面体的分子
,是结构呈正四面体的分子
D. KF的电子式为![]() ,它是易溶于水的离子化合物
,它是易溶于水的离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硫及其化合物的说法正确的是( )

A.浓硫酸具有脱水性,可用于干燥氨气
B.加氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有![]()
C.二氧化硫能使溴水、酸性高锰酸钾溶液褪色,因其有漂白性
D.如图装置中血红色褪去,可以验证 SO2 的还原性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com