
����Ŀ��Ԫ��A��B��C���Ƕ�����Ԫ�أ�AԪ��ԭ�ӵ�2p�����ֻ������δ�ɶԵ��ӣ�B��3p������пչ����A��Bͬ���壬B��Cͬ���ڣ�C�DZ������е縺�����ģ�
��ش�
��1��Aԭ�ӵĺ�������Ų��ĵ����Ų�ͼ ______________ ��Bԭ�ӵĺ�������Ų�ʽ________��Cԭ�ӵļ۵����Ų�ʽ____________��
��2��A��B��C����̬�⻯��Ļ�ѧʽ�ֱ���___________��������ȶ�����__________��
��3�����ǵ�����������ˮ�����У�������ǿ����_________��
��4��AC4�Ļ�ѧʽ___________���ṹʽ__________������ԭ��A���ӻ���ʽ________�ӻ�����__________�����������������Ǽ�������������
���𰸡�![]() 1s22s22p63s23p2 3s23p5 CH4��SiH4��HCl SiH4 HClO4 CCl4��
1s22s22p63s23p2 3s23p5 CH4��SiH4��HCl SiH4 HClO4 CCl4�� 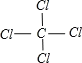 sp3 �Ǽ���
sp3 �Ǽ���
��������
Ԫ��A��B��C���Ƕ�����Ԫ�أ�AԪ��ԭ�ӵ�2p�����ֻ������δ�ɶԵ��ӣ���A����Χ�����Ų�Ϊ2s22p2����AΪ̼Ԫ�أ�B��3p������пչ������B��A����Χ�����Ų�Ϊ3s23p1��3s23p2��A��Bͬ���壬��BΪ��Ԫ�أ�B��Cͬ���ڣ�C�DZ������е縺�����ģ���CΪ��Ԫ�ء�
��1��AΪ̼Ԫ�أ�Cԭ�ӵĺ�������Ų��Ĺ����ʾʽ![]() ��Bԭ��ΪSiԪ�أ�Si�ĺ�������Ų�ʽΪ��1s22s22p63s23p2��CΪClԪ�أ�Clԭ�ӵļ۵����Ų�ʽΪ��3s23p5���ʴ�Ϊ��
��Bԭ��ΪSiԪ�أ�Si�ĺ�������Ų�ʽΪ��1s22s22p63s23p2��CΪClԪ�أ�Clԭ�ӵļ۵����Ų�ʽΪ��3s23p5���ʴ�Ϊ��![]() ��1s22s22p63s23p2��3s23p5��
��1s22s22p63s23p2��3s23p5��
��2��A��B��C�γɵ���̬�⻯��ֱ�Ϊ��CH4��SiH4��HCl����Ϊ�ǽ�����Cl��C��Si�����ڷǽ�����Խǿ������̬�⻯��Խ�ȶ�������Щ�⻯������ȶ�����SiH4���ʴ�Ϊ��SiH4��
��3��A��B��C�γɵ�����������ˮ�������ۺ����ᣩ�ֱ�Ϊ��H2CO3��H2SiO3��HClO4�����ڷǽ�����Խǿ��������Խǿ����������ǿ���ǣ�HClO4���ʴ�Ϊ��HClO4��
��4��AC4ΪCCl4����ṹʽ��������飬Ϊ�������壬��Ϊ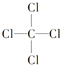 ����������Cԭ�Ӳ�ȡsp3�ӻ���CCl4�������ɼ��Լ����ɵķǼ��Է��ӣ��ʴ�Ϊ��
����������Cԭ�Ӳ�ȡsp3�ӻ���CCl4�������ɼ��Լ����ɵķǼ��Է��ӣ��ʴ�Ϊ�� ��sp3���Ǽ��ԡ�
��sp3���Ǽ��ԡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ�����HgCl2��������ľ�ĺͽ��ʱ걾�ı��桢Ƥ�����ƺ�����ʴ���Ƿ�����ѧ����Ҫ�Լ��������������ͷ�������
��1����HgCl2��ˮ������ˮ�⣺HgCl2+H2O![]() Hg(OH)Cl+HCl��Ϊ������������Ӧ����HgCl2��ˮ�⣬���Բ�ȡ�Ĵ�ʩ��_________����ѡ���ţ�
Hg(OH)Cl+HCl��Ϊ������������Ӧ����HgCl2��ˮ�⣬���Բ�ȡ�Ĵ�ʩ��_________����ѡ���ţ�
a. ��ˮϡ�� b. ����HCl��Ũ�� c. ��ʱ���߲��� d. ����
��HgCl2��ϡ��ˮ��Ӧ���������ܽ�İ����Ȼ�������ѧ����ʽΪ��HgCl2+2NH3��Hg(NH3)Cl��+NH4Cl��������Ӧ�Ķ�����Ԫ���У��ǽ�������ǿԪ��ԭ�ӵ����������Ų�ʽΪ_______����ԭ�Ӻ����������______�ֲ�ͬ����չ����
��2����֪PCl3��NH3���ӽṹ���ƣ�PCl3�ĵ���ʽ��________��PCl3��NH3�ķе�Ƚϣ�_____�ߣ���ԭ����_____________��
��3������һ���⻯��HN3�������л��ϳɣ���������������ƣ���HN3�백ˮ��ϣ��˷�Ӧ�Ļ�ѧ����ʽ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����Ӧ�����ӷ���ʽ��ȷ����
A. ����Na2CO3��Һ��CaSO4���巴Ӧ��CO32+CaSO4![]() CaCO3+SO42
CaCO3+SO42
B. �ữNaIO3��NaI�Ļ����Һ��I +IO3+6H+![]() I2+3H2O
I2+3H2O
C. KClO������Һ��Fe(OH)3��Ӧ��3ClO+2Fe(OH)3![]() 2FeO42+3Cl+4H++H2O
2FeO42+3Cl+4H++H2O
D. ��ⱥ��ʳ��ˮ��2Cl+2H+![]() Cl2��+ H2��
Cl2��+ H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Һ��ȼ�ϵ�����������ȼ�ϵ�ؾ������С���ŵ㣮һ����Һ̬�£�N2H4��Ϊȼ�ϵĵ��װ����ͼ��ʾ���õ���ÿ����е�������Ϊ��������KOH��Һ��Ϊ�������Һ�����й��ڸõ�ص���������ȷ���ǣ� ��

A.a���ķ�Ӧʽ��N2H4+4OH����4e���TN2��+4H2O
B.�ŵ�ʱ�����Ӵ�a��������������b��
C.�õ�س����ŵ�ʱ�����ӽ���Ĥ��ѡ�������ӽ���Ĥ
D.��·��ת�Ƶ���3NAʱ��������16.8 L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ϣһ����ͬ�����ܡ����Ƚ������Թ��ɸ��ºϽ𡢵��ȺϽ𡢾��ܺϽ�ȣ����ں��ա�����������DZ��ȹ�ҵ���š�
��Ϣ�����Ȼ�����(CrO2Cl2)�Ǹ���һ�ֻ���������¸û������ǰ���ɫҺ�壬�۵�Ϊ-96.5�����е�Ϊ117�����ܺͱ�ͪ(CH3COCH3)�����Ȼ�̼��CS2���л��ܼ����ܡ�
��1����(24��Ԫ��) ��̬ԭ�ӵĵ����Ų�ʽΪ___________��
��2��CH3COCH3�������________������������____________��������
��3����̬�Ȼ���������______________���壬��ͪ��̼ԭ�ӵ��ӻ���ʽΪ______________������̼����______________(���������������Ǽ�����)���ӣ������к���____________(���������������Ǽ�����)����
��4��K[Cr(C2O4)2(H2O)2]Ҳ�Ǹ���һ�ֻ�����û������������ӻ�������г������Ӽ������ۼ��⣬������____________����
��5���������ľ�����ͼ��ʾ��һ�������к���_______����ԭ�ӡ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ֶ�����Ԫ�أ����ǵĽṹ�����ʵ���Ϣ���±�������
Ԫ�� | �ṹ�����ʵ���Ϣ |
A | �Ƕ������У���ϡ�������⣩ԭ�Ӱ뾶����Ԫ�أ���Ԫ�ص�ij�ֺϽ���ԭ�ӷ�Ӧ�ѵĵ��ȼ� |
B | B��Aͬ���ڣ�������������ˮ��������� |
C | Ԫ�ص���̬�⻯�K������ˮ������������� |
D | �Ǻ�ˮ�г��⡢��Ԫ���⺬������Ԫ�أ��䵥�ʻ���Ҳ������ˮ���������г��õ�����ɱ���� |
����ݱ�����Ϣ��д��
��1��Aԭ�ӵĺ�������Ų�ʽ______��
��2�����Ӱ뾶��B____A����������������С��������
��3��Cԭ�ӵĵ����Ų�ͼ��____����ԭ�Ӻ�����___��δ�ɶԵ�����������ߵĵ���Ϊ___����ϵĵ��ӣ�������____����
��4��Dԭ�ӵ�����ռԭ�ӹ����Ϊ_______����D���Ľṹʾ��ͼ��_____��
��5��BD3��ˮ��Һ��______�ԣ�ԭ��_____________________�������ӷ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��4FeO42-+10H2O=4Fe(OH)3��+8OH-+3O2�� �����c(FeO42-)�ڲ�ͬ�����±仯��ͼ�ס��ҡ���������ʾ��

����˵����ȷ����
A. ͼ�ױ���������������ͬʱ���¶�Խ��FeO42-ת������Խ��
B. ͼ�ұ���������������ͬʱ������ԽǿFeO42-ת������Խ��
C. ͼ������������������ͬʱ�����ζ���FeO42-�������ȶ���
D. ͼ������������������ͬʱ������������Fe3+�ܼӿ�FeO42-��ת��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס�����ͬѧ������ԭ��ط�Ӧ��������Ļ��ǿ�������˾���þƬ����Ƭ���缫������ͬѧ�����缫����6mol��L��1��H2SO4��Һ�У���ͬѧ�����缫����6mol��L��1��NaOH��Һ�У�װ����ͼ��ʾ��

��1��д��ͼ1�������ĵ缫��Ӧʽ�� _______________ ��
��2��ͼ2�и���Ϊ _______________ ���ܷ�Ӧ�����ӷ���ʽΪ ____________ ��
��3���ס���ͬѧ����Ϊ���������ԭ��صĵ缫���϶��ǽ��������������Ľ���Ӧ���������Ľ������á������ͬѧ�ó��Ľ����� _______________ �Ļ�Ը�ǿ����ͬѧ�ó��Ľ����� _______________ �Ļ�Ը�ǿ��
��4���ɸ�ʵ��ó������н����У���ȷ���� _______________ ������ţ���
a������ԭ��ط�Ӧ�жϽ������ǿ��ʱӦע��ԭ����еĵ������Һ
b��þ�Ľ����Բ�һ�������Ľ�����ǿ
c����ʵ��˵���������˳����ѹ�ʱ��û��ʵ�ü�ֵ
d����ʵ��˵����ѧ�о������ӣ���Ӧ������Ӱ��ϴ����Ӧ��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ��װ���ܴﵽʵ��Ŀ����(�г�����δ����)��������

A. װ�â����ڼ�����������ȥ���ɵ���ϩ B. װ�â�����ʯ�͵ķ���
C. װ�â�����ʵ������������ D. װ�âܿ�֤�����ԣ����̼�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com